
【题目】为证明过氧化钠可在呼吸面具和潜水艇中作为氧气的来源,某化学兴趣小组选择适当的化学试剂和实验用品,用如图所示的装置(C中盛放的是过氧化钠)进行实验。回答下列问题:

(1)a的名称______。
(2)A是实验室中制取CO2的装置。写出A中发生反应的离子方程式:______。
(3)填写如表中的空白。
装置序号 | 加入的试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | ____ |
D | ____ | ____ |
(4)写出C中发生反应的化学方程式:______。
(5)F中得到气体的检验方法______。
(6)为了测定某碳酸钠样品的纯度,完成如下实验:在电子天平上准确称取三份灼烧至恒重的无水Na2CO3样品(杂质不与盐酸反应)0.4000g于250mL锥形瓶中,用50mL水溶解后,加2~3滴______作指示剂,然后用0.2000molL-1HCl标准液滴定,滴定终点的实验现象为______。已知:Na2CO3与HCl的滴定反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑,滴定时实验数据列表如表:
实验次数编号 | 0.2000molL-1HCl溶液的体积(mL) | |
滴定前刻度 | 滴定后刻度 | |
1 | 1.00 | 31.50 |
2 | 5.00 | 34.50 |
3 | 7.00 | 42.50 |
选取上述合理数据,计算出碳酸钠样品的纯度为______。
【答案】分液漏斗 CaCO3+2H+=Ca2++H2O+CO2↑ 除去CO2气体中混入的HCl NaOH溶液 吸收未反应的CO2气体 2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑ 将带火星的木条伸入瓶中,若木条复燃证明O2 甲基橙 溶液由黄色变为橙色,且半分钟之内无变化 79.5%
【解析】
A中CaCO3+2HCl=CaCl2+H2O+CO2↑,制备CO2,B中装有饱和NaHCO3溶液除去CO2中少量HCl,C中盛放的是过氧化钠,发生反应2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑,D中放NaOH溶液,吸收未反应的CO2气体,E收集生成的O2。
(1)a的名称分液漏斗,故答案为:分液漏斗;
(2)A是实验室中制取CO2,化学反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,离子反应方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)
装置序号 | 加入的试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl |
D | NaOH溶液 | 吸收未反应的CO2气体 |
故答案为:除去CO2气体中混入的HCl;NaOH溶液;吸收未反应的CO2气体;
(4)C中盛放的是过氧化钠,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑,故答案为:Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑;
(5)F中得到气体为氧气,其检验方法:将带火星的木条伸入瓶中,若木条复燃证明O2,
故答案为:将带火星的木条伸入瓶中,若木条复燃证明O2;
(6)盐酸滴定碳酸钠,碳酸钠显碱性,可用甲基橙作指示剂,已知:Na2CO3与HCl的滴定反应为Na2CO3+2HCl═2NaCl+H2O+CO2↑,滴定终点的实验现象溶液由黄色变为橙色,且半分钟之内无变化,由实验数据分析可知,实验次数编号为3的实验误差大,不可用,由1、2平均可得,消耗的盐酸体积为30.0mL,由反应方程式可知,Na2CO3∽2HCl,碳酸钠的物质的量为:n(Na2CO3)=1/2n(HCl)=1/2×0.2000molL×0.03L=0.003mol,m(Na2CO3)= 0.003mol×106g·mol-1=0.318g,碳酸钠样品的纯度为![]() ×100%=79.5%,故答案为:甲基橙;溶液由黄色变为橙色,且半分钟之内无变化;79.5%;
×100%=79.5%,故答案为:甲基橙;溶液由黄色变为橙色,且半分钟之内无变化;79.5%;


科目:高中化学 来源: 题型:
【题目】Ⅰ.有机物A的质谱图和红外光谱图分别如下:
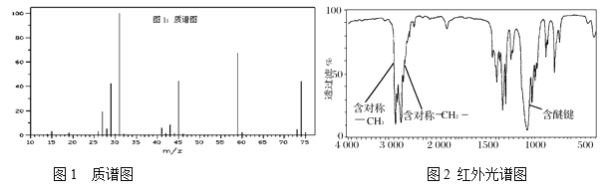
(1)A的结构简式为________。
Ⅱ.相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现B的氢谱如图:

(2)B的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是

A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是4种短周期主族元素,在周期表中的相对位置如表,已知四种元素的原子最外层电子数之和为18,则以下说法中正确的是( )
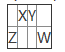
A.Y的最高正化合价与最低负化合价的代数和为2
B.X、Y、Z、W四种原子中,X的原子半径最小
C.Y的氢化物的沸点一定高于X的氢化物的沸点
D.X、Y、W三种元素氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)![]() N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:
N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:

下列说法正确的是
A.组别①中0 ~20 min内,NO2降解速率为0.0125molL-1min-1
B.由实验数据可知温度T1<T2
C.40min时,表格中M对应的数据为0.18
D.该反应只有在高温下才能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg![]() 与温度(t)的关系曲线如右图。下列说法正确的是
与温度(t)的关系曲线如右图。下列说法正确的是

A. 通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
B. CO不适宜用于工业冶炼金属Cr
C. CO还原PbO2的反应ΔH>0
D. 工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com