
ЎҫМвДҝЎҝјЧҙјКЗТ»ЦЦРВРНИјБПЈ¬јЧҙјИјБПөзіШјҙҪ«ҙУКөСйКТЧЯПт№ӨТө»ҜЙъІъЎЈ№ӨТөЙПТ»°гТФCOәНH2ОӘФӯБПәПіЙјЧҙјЈ¬ёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪОӘЈә CO(g)+ 2H2(g)![]() CH3OH(g) ЎчH1ЈҪЈӯ116 kJЎӨmolЈӯ1
CH3OH(g) ЎчH1ЈҪЈӯ116 kJЎӨmolЈӯ1
ЈЁ1Ј©ТСЦӘЈә![]() ЎчH2ЈҪЈӯ283 kJЎӨmolЈӯ1
ЎчH2ЈҪЈӯ283 kJЎӨmolЈӯ1
![]() ЎчH3ЈҪЈӯ242 kJЎӨmolЈӯ1
ЎчH3ЈҪЈӯ242 kJЎӨmolЈӯ1
ФтұнКҫ1molЖшМ¬јЧҙјНкИ«ИјЙХЙъіЙCO 2әНЛ®ХфЖшКұөДИИ»ҜС§·ҪіМКҪОӘЈә
_______________________________________________Ј»
ЈЁ2Ј©ФЪИЭ»эОӘ1LөДәгИЭИЭЖчЦРЈ¬·ЦұрСРҫҝФЪ230ЎжЎў250ЎжЎў 270ЎжИэЦЦОВ¶ИПВәПіЙјЧҙјөД№жВЙЎЈУТНјКЗЙПКцИэЦЦОВ¶ИПВІ»Н¬өДH2әНCOөДЖрКјЧйіЙұИЈЁЖрКјКұCOөДОпЦКөДБҝҫщОӘ1molЈ©УлCOЖҪәвЧӘ»ҜВКөД№ШПөЎЈЗл»ШҙрЈә

ўЩФЪЙПКцИэЦЦОВ¶ИЦРЈ¬ЗъПЯZ¶ФУҰөДОВ¶ИКЗ__________
ўЪАыУГНјЦРaөг¶ФУҰөДКэҫЭЈ¬јЖЛгіцЗъПЯZФЪ¶ФУҰОВ¶ИПВCO(g)+ 2H2(g) ![]() CH3OH(g)өДЖҪәвіЈКэK=_____________________ЎЈ
CH3OH(g)өДЖҪәвіЈКэK=_____________________ЎЈ
ЈЁ3Ј©ФЪДіОВ¶ИПВЈ¬Ҫ«Т»¶ЁБҝөДCOәНH2Н¶Ил10LөДГЬұХИЭЖчЦРЈ¬5minКұҙпөҪЖҪәвЈ¬ёчОпЦКөДОпЦКөДЕЁ¶И(molL-1)ұд»ҜИзПВұнЛщКҫЈә
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
Иф5minЎ«10minЦ»ёДұдБЛДіТ»МхјюЈ¬ЛщёДұдөДМхјюКЗ_________________________Ј»ЗТёГМхјюЛщёДұдөДБҝКЗ_______________ЎЈ
Ўҫҙр°ёЎҝCH3OH(g)+3/2O2(g)== CO2(g)+ 2H2O(g) ЎчHЈҪЈӯ651kJЎӨmol-1270Ўж4 L2 /mol2ФцҙуH2өДЕЁ¶ИФцҙуБЛ0.1 molL-1
ЎҫҪвОцЎҝ
(1) ўЩCO(g)+ 2H2(g)![]() CH3OH(g) ЎчH1ЈҪЈӯ116 kJЎӨmolЈӯ1Ј»ўЪТСЦӘЈә
CH3OH(g) ЎчH1ЈҪЈӯ116 kJЎӨmolЈӯ1Ј»ўЪТСЦӘЈә![]() ЎчH2ЈҪЈӯ283 kJЎӨmolЈӯ1Ј»ўЫ
ЎчH2ЈҪЈӯ283 kJЎӨmolЈӯ1Ј»ўЫ![]() ЎчH3ЈҪЈӯ242 kJЎӨmolЈӯ1Ј¬ёщҫЭёЗЛ№¶ЁВЙ·ЦОцЈ¬Ҫ«·ҪіМКҪҪшРРјЖЛгЈ¬№«КҪОӘ--ўЪ+ўЫЎБ2-ўЩјҙҝЙөГИИ»ҜС§·ҪіМКҪОӘЈә
ЎчH3ЈҪЈӯ242 kJЎӨmolЈӯ1Ј¬ёщҫЭёЗЛ№¶ЁВЙ·ЦОцЈ¬Ҫ«·ҪіМКҪҪшРРјЖЛгЈ¬№«КҪОӘ--ўЪ+ўЫЎБ2-ўЩјҙҝЙөГИИ»ҜС§·ҪіМКҪОӘЈә
CH3OH(g)+3/2O2(g)== CO2(g)+ 2H2O(g) ЎчHЈҪ-283-242ЎБ2+116=Јӯ651kJЎӨmol-1 Ј»
(2)ёщҫЭ·ҙУҰCO(g)+ 2H2(g)![]() CH3OH(g) ЎчH1ЈҪЈӯ116 kJЎӨmolЈӯ1·ЦОцЈ¬ёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬ОВ¶ИФҪёЯЈ¬ЧӘ»ҜВКФҪөНЈ¬ЛщТФЗъПЯZ¶ФУҰөДОВ¶ИКЗ 270ЎжЈ»
CH3OH(g) ЎчH1ЈҪЈӯ116 kJЎӨmolЈӯ1·ЦОцЈ¬ёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬ОВ¶ИФҪёЯЈ¬ЧӘ»ҜВКФҪөНЈ¬ЛщТФЗъПЯZ¶ФУҰөДОВ¶ИКЗ 270ЎжЈ»
(3) CO(g)+ 2H2(g)![]() CH3OH(g) Ј¬ёГ·ҙУҰөДЖҪәвіЈКэK=
CH3OH(g) Ј¬ёГ·ҙУҰөДЖҪәвіЈКэK= ![]() Ј¬aөгКұЈ¬Т»Сх»ҜМјөДЧӘ»ҜВКОӘ50%Ј¬·ҙУҰПыәДБЛ1molТ»Сх»ҜМјЈ¬ПыәД2molЗвЖшЈ¬КЈУа1molТ»Сх»ҜМјЈ¬ЗвЖшөДОпЦКөДБҝОӘ3-2=1molЈ¬ЙъіЙ1molјЧҙјЈ¬aөгёчЧй·ЦөДЕЁ¶ИКЗјЧҙјөДЕЁ¶ИОӘ1/2=0.5mol/LЈ¬Т»Сх»ҜМјөДОпЦКөДБҝЕЁ¶ИОӘ1/2=0.5,mol/LЈ¬ЗвЖшөДОпЦКөДБҝЕЁ¶ИОӘ1/2=0.5mol/LЈ¬ФтЖҪәвіЈКэОӘ=
Ј¬aөгКұЈ¬Т»Сх»ҜМјөДЧӘ»ҜВКОӘ50%Ј¬·ҙУҰПыәДБЛ1molТ»Сх»ҜМјЈ¬ПыәД2molЗвЖшЈ¬КЈУа1molТ»Сх»ҜМјЈ¬ЗвЖшөДОпЦКөДБҝОӘ3-2=1molЈ¬ЙъіЙ1molјЧҙјЈ¬aөгёчЧй·ЦөДЕЁ¶ИКЗјЧҙјөДЕЁ¶ИОӘ1/2=0.5mol/LЈ¬Т»Сх»ҜМјөДОпЦКөДБҝЕЁ¶ИОӘ1/2=0.5,mol/LЈ¬ЗвЖшөДОпЦКөДБҝЕЁ¶ИОӘ1/2=0.5mol/LЈ¬ФтЖҪәвіЈКэОӘ= ![]() = 4 L2 /mol2
= 4 L2 /mol2
(4)·ҙУҰҙпөҪЖҪәвКұЈ¬ёщҫЭ·ҙУҰ·ҪіМКҪҝЙЦӘёчОпЦКөДОпЦКөДБҝөД№ШПөЈ¬Т»Сх»ҜМјөДЕЁ¶ИОӘ0.1-0.04=0.06mol/LЈ¬ЗвЖшөДЕЁ¶ИОӘ0.2-0.08=0.12mol/LЈ¬10·ЦЦУКұТ»Сх»ҜМјөДЕЁ¶ИјхРЎЈ¬ЗвЖшөДЕЁ¶ИФцҙуЈ¬јЧҙјөДЕЁ¶ИФцҙуЈ¬ФтЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ө«ЗвЖшөДЕЁ¶ИФцҙуЈ¬ЛөГчёДұдөДОпАнБҝОӘФцҙуH2өДЕЁ¶ИЈ¬ЗвЖшөДЕЁ¶ИФцҙуБЛ0.2-0.12+0.02= 0.1 molL-1ЎЈ


 ҪтЗЕҪМУэјЖЛгРЎЧҙФӘПөБРҙр°ё
ҪтЗЕҪМУэјЖЛгРЎЧҙФӘПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіНӯҝуКҜөДЦчТӘіЙ·ЦКЗCu2OЈ¬»№ә¬УРЙЩБҝөДAl2O3ЎўFe2O3әНSiO2ЎЈДі№Өі§АыУГҙЛҝуКҜБ¶ЦЖҫ«НӯөД№ӨТХБчіМИзНјЛщКҫ(ТСЦӘЈәCu2OЈ«2HЈ«===CuЈ«Cu2Ј«Ј«H2O)ЎЈ
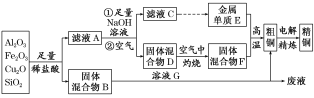
(1)ВЛТәAЦРМъФӘЛШөДҙжФЪРОКҪОӘ________________(МоАлЧУ·ыәЕ)Ј¬ЙъіЙёГАлЧУөДАлЧУ·ҪіМКҪОӘ____________________________Ј¬јмСйВЛТәAЦРҙжФЪёГАлЧУөДКФјБОӘ__________________ЎЈ
(2)ИЬТәGУл№ММе»мәПОпB·ҙУҰөДАлЧУ·ҪіМКҪОӘ__________________________________________________ЎЈ
(3)Ҫ«Na2CO3ИЬТәөОИлөҪТ»¶ЁБҝөДCuCl2ИЬТәЦРЈ¬өГөҪВИ»ҜДЖЎў¶юСх»ҜМјәНТ»ЦЦВМЙ«өДІ»ИЬУЪЛ®өДСО(І»ә¬Ҫбҫ§Л®)Ј¬ёГСОКЬИИ·ЦҪвІъЙъИэЦЦСх»ҜОпЈ¬ФтёГСОөД»ҜС§КҪКЗ____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪЎ°ВМЙ«»ҜС§№ӨТХЎұЦРЈ¬АнПлЧҙМ¬КЗ·ҙУҰОпЦРөДФӯЧУИ«ІҝЧӘ»ҜОӘУыЦЖөГөДІъОпЈ¬јҙФӯЧУАыУГВКОӘ100%ЎЈПВБР·ҙУҰАаРНДЬМеПЦЎ°ФӯЧУҫӯјГЎұФӯФтөДКЗ(ЎЎЎЎ)
ўЩЦГ»»·ҙУҰЎЎўЪ»ҜәП·ҙУҰЎЎўЫ·ЦҪв·ҙУҰЎЎўЬИЎҙъ·ҙУҰ
ўЭјУіЙ·ҙУҰЎЎўЮёҙ·ЦҪв·ҙУҰЎЎўЯјУҫЫ·ҙУҰ
A. ўЩўЪўЭ B. ўЪўЭўЯ C. ўЮўЯ D. Ц»УРўЯ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝCaCO3УлПЎСОЛб·ҙУҰЈЁ·ЕИИ·ҙУҰЈ©ЙъіЙCO2өДБҝУл·ҙУҰКұјдөД№ШПөИзНјЛщКҫЎЈПВБРҪбВЫІ»ХэИ·өДКЗ
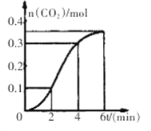
AЈ®·ҙУҰҝӘКј2·ЦЦУДЪЖҪҫщ·ҙУҰЛЩВКЧоҙу
BЈ®·ҙУҰ4·ЦЦУәуЖҪҫщ·ҙУҰЛЩВКЧоРЎ
CЈ®·ҙУҰҝӘКј4·ЦЦУДЪОВ¶И¶Ф·ҙУҰЛЩВКөДУ°ПмұИЕЁ¶Иҙу
DЈ®·ҙУҰ4·ЦЦУәу·ҙУҰЛЩВКПВҪөөДФӯТтКЗСОЛбЕЁ¶ИЦрҪҘјхРЎ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРОпЦКІ»ҝЙДЬКЗТТП©јУіЙІъОпөДКЗ ЈЁ Ј©
A.CH3CH3B.CH3CHCl2C.CH3CH2OHD.CH3CH2Br
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝјЧҙјЛ®ХфЖшЦШХыЦЖЗвЈЁSRMЈ©КЗУГУЪЗэ¶Ҝөз¶ҜЖыіөөДЦКЧУҪ»»»ДӨИјБПөзіШөДАнПлЗвФҙЈ¬өұЗ°СРҫҝЦчТӘјҜЦРФЪМбёЯҙЯ»ҜјБ»оРФәНҪөөНОІЖшЦРCOә¬БҝЈ¬ТФГвК№ИјБПөзіШPtөзј«ЦР¶ҫЎЈЦШХы№эіМ·ўЙъөД·ҙУҰИзПВЈә
·ҙУҰI CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ҰӨH1
CO2(g)+3H2(g) ҰӨH1
·ҙУҰўт CH3OH(g)![]() CO(g)+2H2(g) ҰӨH2
CO(g)+2H2(g) ҰӨH2
·ҙУҰўу CO(g)+H2O(g)![]() CO2(g)+H2(g) ҰӨH3
CO2(g)+H2(g) ҰӨH3
Жд¶ФУҰөДЖҪәвіЈКэ·ЦұрОӘK1ЎўK2ЎўK3Ј¬ЖдЦРK2ЎўK3ЛжОВ¶Иұд»ҜИзПВұнЛщКҫЈә
125Ўж | 225Ўж | 325Ўж | |
K2 | 05535 | 1858 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
Зл»ШҙрЈә
ЈЁ1Ј©·ҙУҰўтДЬ№»ЧФ·ўҪшРРөДМхјю_______ЈЁМоЎ°өНОВЎұЎўЎ°ёЯОВЎұ»тЎ°ИОәООВ¶ИЎұЈ©Ј¬ҰӨH1____ҰӨH3ЈЁМоЎ°>ЎұЎўЎ°<Ўұ»тЎ°=ЎұЈ©ЎЈ
ЈЁ2Ј©ПаН¬МхјюПВЈ¬јЧҙјЛ®ХфЖшЦШХыЦЖЗвҪПјЧҙјЦұҪУ·ЦҪвЦЖЗвЈЁ·ҙУҰўтЈ©өДПИҪшЦ®ҙҰФЪУЪ___________________________________________________________________ЎЈ
ЈЁ3Ј©ФЪіЈС№ЎўCat.1ҙЯ»ҜПВЈ¬CH3OHәНH2O»мәНЖшМеЈЁМе»эұИ1ЎГ1.2Ј¬ЧЬОпЦКөДБҝ2.2molЈ©ҪшРР·ҙУҰЈ¬tlКұҝМІвөГCH3OHЧӘ»ҜВКј°COЎўCO2СЎФсРФЛжОВ¶Иұд»ҜЗйҝц·ЦұрИзНјЛщКҫЈЁCOЎўCO2өДСЎФсРФЈәЧӘ»ҜөДCH3OHЦРЙъіЙCOЎўCO2өД°Щ·ЦұИЈ©ЎЈ

ЧўЈәЗъПЯaұнКҫCH3OHөДЧӘ»ҜВКЈ¬ЗъПЯbұнКҫCOөДСЎФсРФЈ¬ЗъПЯcұнКҫCO2өДСЎФсРФ
ўЩ ПВБРЛө·ЁІ»ХэИ·өДКЗ__________ЎЈ
AЈ®·ҙУҰККТЛОВ¶ИОӘ300Ўж
BЈ®№ӨТөЙъІъНЁіЈФЪёәС№МхјюПВҪшРРјЧҙјЛ®ХфЖшЦШХы
CЈ®јәЦӘCat.2ҙЯ»ҜјБҫЯУРёьёЯҙЯ»Ҝ»оРФЈ¬ҝЙМбёЯјЧҙјЖҪәвЧӘ»ҜВК
DЈ®МнјУCaOөДёҙәПҙЯ»ҜјБҝЙМбёЯЗвЖшІъВК
ўЪ 260ЎжКұH2ОпЦКөДБҝЛжКұјдөДұд»ҜЗъПЯИзНјЛщКҫЎЈ»ӯіц300ЎжКұЦБt1КұҝМH2ОпЦКөДБҝЛжКұјдөДұд»ҜЗъПЯЎЈ________________

ЈЁ4Ј©ёұІъОпCO2ҝЙТФФЪЛбРФЛ®ИЬТәЦРөзҪвЙъіЙјЧЛбЈ¬ЙъіЙјЧЛбөДөзј«·ҙУҰКҪКЗЈә___________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶МЦЬЖЪЦчЧеФӘЛШXЎўYЎўZЎўQЎўRөДФӯЧУРтКэТАҙОФцҙуЈ¬ЖдЦРXөДөҘЦККЗГЬ¶ИЧоРЎөДЖшМеЈ¬ZКЗН¬ЦЬЖЪЦРФӯЧУ°лҫ¶ЧоҙуөДФӘЛШЈ¬YУлQН¬ЦчЧеЈ¬ЗТQөДФӯЧУРтКэКЗYөДБҪұ¶ЎЈ»ШҙрПВБРОКМвЈә
(1)ZөДФӯЧУҪб№№КҫТвНјОӘ__________Ј¬RФЪФӘЛШЦЬЖЪұнЦРөДО»ЦГКЗ______________ЎЈ
(2)ZөДЧоёЯјЫСх»ҜОп¶ФУҰЛ®»ҜОпЛщә¬»ҜС§јьАаРНКЗ_______________ЎЈQЎўRөДЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпЛбРФҪПЗҝөДКЗ__________(Мо»ҜС§КҪ)ЎЈ
(3)УЙXәНYҝЙТФРОіЙТ»ЦЦТәМ¬»ҜәПОпTЈ¬T·ЦЧУә¬18ёцөзЧУЈ¬ФтЖдөзЧУКҪОӘ_______ЎЈҪ«QөДөНјЫСх»ҜОпНЁИлTҝЙТФЙъіЙТ»ЦЦЗҝЛбЈ¬·ҙУҰөД»ҜС§·ҪіМКҪОӘ___________________ЎЈ
(4)өӘФӘЛШөДТ»ЦЦЗв»ҜОпMЈ¬M·ЦЧУә¬18ёцөзЧУЈ¬УГ¶иРФөзј«Ј¬MЎўСхЖшәНZөДЧоёЯјЫСх»ҜОп¶ФУҰЛ®»ҜОпөДИЬТәЙијЖТ»ёцИјБПөзіШЈ¬ФтM·ўЙъөДөзј«·ҙУҰКҪОӘ______________________ЎЈ
(5)ФЪ2 LГЬұХИЭЖчЦР·ЦұрідИл4 mol AЖшМеәН6 mol BЖшМеЈ¬ФЪТ»¶ЁМхјюПВ·ўЙъ·ҙУҰЈә4A(g)Ј«5B(g)![]() 4C(g)Ј«xD(g)Ј¬5minәуҙпөҪЖҪәвЧҙМ¬Ј¬ҫӯІв¶ЁBөДЧӘ»ҜВКОӘ75%Ј¬DөДЕЁ¶ИОӘ2.7 molЎӨLЈӯ1ЎЈФтxЈҪ_______Ј»AФЪЖҪәв»мәПОпЦРөДМе»э·ЦКэОӘ________Ј»ҙУ·ҙУҰҝӘКјЦБЖҪәвКұЈ¬ТФCөДЕЁ¶Иұд»ҜұнКҫёГ·ҙУҰөДЖҪҫщЛЩВКv(C)ЈҪ_____________ЎЈ
4C(g)Ј«xD(g)Ј¬5minәуҙпөҪЖҪәвЧҙМ¬Ј¬ҫӯІв¶ЁBөДЧӘ»ҜВКОӘ75%Ј¬DөДЕЁ¶ИОӘ2.7 molЎӨLЈӯ1ЎЈФтxЈҪ_______Ј»AФЪЖҪәв»мәПОпЦРөДМе»э·ЦКэОӘ________Ј»ҙУ·ҙУҰҝӘКјЦБЖҪәвКұЈ¬ТФCөДЕЁ¶Иұд»ҜұнКҫёГ·ҙУҰөДЖҪҫщЛЩВКv(C)ЈҪ_____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёщҫЭМвТвНкіЙПВБРОКМвЈә
(1)№ӨТөЙПАыУГCOәНЛ®ХфЖшФЪТ»¶ЁМхјюПВ·ўЙъ·ҙУҰЦЖИЎЗвЖшЈә
CO(g)Ј«H2O(g) ![]() CO2(g)Ј«H2(g) ЎчHЈҪЈӯ41 kJ/mol
CO2(g)Ј«H2(g) ЎчHЈҪЈӯ41 kJ/mol
ТСЦӘЈә2H2 (g) + O2 (g) = 2H2O (g) ҰӨHЈҪЈӯ484 kJ/molЈ¬РҙіцCOНкИ«ИјЙХЙъіЙCO2өДИИ»ҜС§·ҪіМКҪЈә_______________________________________ЎЈ
(2)ЛжЧЕҙуЖшОЫИҫөДИХЗчСПЦШЈ¬Ў°ҪЪДЬјхЕЕЎұЈ¬јхЙЩИ«ЗтОВКТЖшМеЕЕ·ЕЈ¬СРҫҝNO xЎўSO2ЎўCOөИҙуЖшОЫИҫЖшМеөДҙҰАнҫЯУРЦШТӘТвТеЎЈУГ»оРФМҝ»№Фӯ·ЁҙҰАнөӘСх»ҜОпЈ¬УР№Ш·ҙУҰОӘ:C(s)Ј«2NO(g)![]() N2(g)Ј«CO2(g)ЎЈДіСРҫҝРЎЧйПтДіГЬұХИЭЖчјУИлТ»¶ЁБҝөД»оРФМҝәНNOЈ¬әгОВ(T1Ўж)МхјюПВ·ҙУҰЈ¬·ҙУҰҪшРРөҪІ»Н¬КұјдІвөГёчОпЦКөДЕЁ¶ИИзПВЈә
N2(g)Ј«CO2(g)ЎЈДіСРҫҝРЎЧйПтДіГЬұХИЭЖчјУИлТ»¶ЁБҝөД»оРФМҝәНNOЈ¬әгОВ(T1Ўж)МхјюПВ·ҙУҰЈ¬·ҙУҰҪшРРөҪІ»Н¬КұјдІвөГёчОпЦКөДЕЁ¶ИИзПВЈә
ЕЁ¶И/molЎӨLЈӯ1 Кұјд/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
ўЩФтҙУ·ҙУҰҝӘКјөҪ20minКұЈ¬ТФNOұнКҫөДЖҪҫщ·ҙУҰЛЩВК= ________Ј¬ёГОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэKЈҪ____ЈЁұЈБфБҪО»РЎКэЈ©
ўЪ30minәуЈ¬ёДұдДіТ»МхјюЈ¬·ҙУҰЦШРВҙпөҪЖҪәвЈ¬ФтёДұдөДМхјюҝЙДЬКЗ_____ЈЁРҙТ»МхјҙҝЙЈ©ЎЈ
ўЫПВБРГиКцЦРДЬЛөГчЙПКц·ҙУҰТСҙпЖҪәвөДКЗ__________Ј»
AЎўИЭЖчДЪЖшМеөДЖҪҫщДҰ¶ыЦКБҝұЈіЦІ»ұд
BЎў2v(NO)Хэ=v(N2)Дж
CЎўИЭЖчЦРЖшМеөДС№ЗҝұЈіЦІ»ұд
DЎўөҘО»КұјдДЪЙъіЙnmolCO2өДН¬КұЙъіЙ2nmolNO
(3)АыУГFe2+ЎўFe3+өДҙЯ»ҜЧчУГЈ¬іЈОВПВҪ«SO2ЧӘ»ҜОӘSO42ЈӯЈ¬ ¶шКөПЦSO2өДҙҰАнЈЁЧЬ·ҙУҰОӘ2SO2+O2+2H2OЈҪ2H2SO4Ј©ЎЈТСЦӘЈ¬ә¬SO2өД·ПЖшНЁИлә¬Fe2+ЎўFe3+өДИЬТәКұЈ¬ЖдЦРТ»ёц·ҙУҰөДАлЧУ·ҪіМКҪОӘ4Fe2+ + O2+ 4H+ ЈҪ4Fe3+ + 2H2OЈ¬ФтБнТ»·ҙУҰөДАлЧУ·ҪіМКҪОӘ_______________
(4)УРС§ХЯПлТФИзНјЛщКҫЧ°ЦГУГФӯөзіШФӯАнҪ«SO2ЧӘ»ҜОӘЦШТӘөД»Ҝ№ӨФӯБПЎЈ
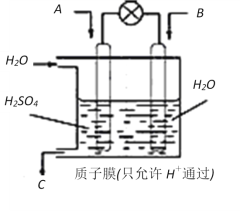
ИфAОӘSO2Ј¬BОӘO2Ј¬CОӘH2SO4Ј¬Фтёәј«·ҙУҰКҪОӘ_______________________________Ј¬өзіШЧЬ·ҙУҰКҪОӘ________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіЦЦЖшМеөДДҰ¶ыЦКБҝОӘM gЎӨmol-1Ј¬Ҫ«ұкҝцПВөДёГЖшМеV LИЬҪвФЪ1000 gЛ®ЦРЈ¬ёГЖшМеІ»УлЛ®·ҙУҰЈ¬ЛщөГИЬТәГЬ¶ИОӘҰС gЎӨcm-3Ј¬ФтЛщөГИЬТәЦРИЬЦКөДОпЦКөДБҝЕЁ¶ИОӘ ( )molЎӨL-1
A.V/22Ј®4B.V ҰС/(MV+22400)
C.V ҰС/22400D.1000V ҰС/(MV+22400)
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com