
25℃时,水的电离达到平衡:H2O H++OH—;ΔH>0,下列叙述正确的是
H++OH—;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
某兴趣小组的同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证物质的性质。

(1)现有以下药品:锌粒、铜片、浓H2SO4、浓HNO3、蒸馏水、NaOH溶液。打开K1,关闭K2,可 制取 ________气体。
制取 ________气体。
(2)某同学用石灰石、醋酸、硅酸钠溶液等药品设计了另一实验。他的实验目的是________________;打开K2,关闭K1,将A中液体加入B中后,观察到的实验现象为___________________________________________________
________________________________________________________ _________。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。
S2O32-和Cl2反应的产物之一为SO42-。下列说法不正确的
A.上述反应中,每生成l mol SO42-,可脱去1 mol Cl2
B.H2O参与该反应,既不做氧化剂又不做还原剂
C.根据该反应可判断氧化性:Cl2 > SO42-
D.该反应中还原剂是S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述与对应图像或数据描述正确的是
A.由下列短周期元素性质的数据推断③元素最高价氧化物对应的水化物碱
性最强
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径最高或最低化合价 | 0.74 | 1.60 +2 | 1.52 +1 | 1.10 +5 | 0.99 +7 | 1.86 +1 | 0.75 +5 | 0.82 +3 |
| —2 | —3 | —1 | —3 |

B.图甲表示Zn—Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2
C.图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变
D.图丙表示周期表的一部分,元素X,Y,Z、W中X的氢化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值,下列说法正确的是
A.在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA
B.1mol/LFeCl3 溶液中所含Fe3+的数目小于NA
C.常温下,1L pH=12的Ba(OH)2 溶液中含OH—的数目为2NA
D.23g NO2和N2O4的混合气体中含有氮原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
LiFePO4新型锂离子动力电池是绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 ,负极 Li-e-== Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向正极移动
D.放电时,在正极上是Li+得电子被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空需要高能的燃料,经常是用四氧化二氮和联氨(N2H4)作为燃料,工业上利用氮气和氢气可以合成氨气,氨又可以进一步制备联氨等。
已知 N2(g)+2O2(g)=2NO2(g) △H =+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =— 534.0kJ/mol
NO2(g)  1/2N2O4(g) △H = —26.35kJ/mol
1/2N2O4(g) △H = —26.35kJ/mol
①写出气态联氨在气态四氧化二氮中燃烧生成氮气和水蒸气的热化学方程式 ▲ ;
②用氨和次氯酸钠按一定物质的量之比混合反应可生成联氨,该反应的化学方程式为 ▲ ;
(2)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用氢氧化钾为电解液,燃料电池放电时的负极反应式为 ▲ ,
如果某段时间内氢氧储罐中共收集到33.6 L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 ▲ mol。
 |
(3)在载人航天器的生态系统中,不仅要求分离除去CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2 = 2CO + O2,CO可用作燃料。
已知该反应的阳极反应为:4OH--4e-= O2↑ + 2H2O,则阴极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
 (1)此反应的化学方程式中
(1)此反应的化学方程式中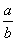 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
(3)平衡时,N的转化率为 。
(4)下列叙述中能说明上述反应达到平衡状态的是
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应反应的离子方程式中,不正确的是 ( )。
A.向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-
NaOH溶液:Mg2++2HCO3-+4OH-
===Mg(OH)2↓+2CO32-+2H2O
B.向NH4Al(SO4)2溶液中滴入B a(OH)2溶液恰好使SO42-反应完全:2Ba2+
a(OH)2溶液恰好使SO42-反应完全:2Ba2+
+4OH-+Al3++2SO42-===2BaSO4↓+AlO2-+2H2O
C.FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+
2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com