
某兴趣小组的同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证物质的性质。

(1)现有以下药品:锌粒、铜片、浓H2SO4、浓HNO3、蒸馏水、NaOH溶液。打开K1,关闭K2,可 制取 ________气体。
制取 ________气体。
(2)某同学用石灰石、醋酸、硅酸钠溶液等药品设计了另一实验。他的实验目的是________________;打开K2,关闭K1,将A中液体加入B中后,观察到的实验现象为___________________________________________________
________________________________________________________ _________。
_________。
科目:高中化学 来源: 题型:
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= ▲ kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= ▲ kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 ▲ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 ▲ 。
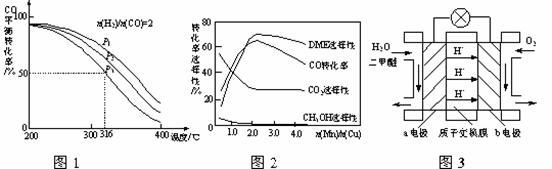
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 ▲ 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 ▲ 。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 ▲ 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 ▲ 。
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:


已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)反应Ⅰ中,需将大理石粉碎、搅拌,同时适当加热,其目的是: ▲ 。
写出反应Ⅰ中主要反应的离子方程式: ▲ 。
(2)上述使用盐酸的浓度为10%,若用37%的浓盐酸来配制500mL的此盐酸所需的玻璃仪器有:玻璃杯、量筒、烧杯、胶头滴管、 ▲ 。
(3)反应Ⅱ中的离子方程式: ▲ 。
(4)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为:
▲ ,若pH过大,则可能发生副反应的离子方程式: ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理或实验操作的叙述正确的是 ( )。
 [
[
A.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上
称量
B.欲除去NO中少量的NO2,将混合气体通入足量NaOH溶液
C.实验室用图1所示装置制取少量氨气
D.实验室用图2所示装置检验火柴头燃烧 产生的SO2
产生的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒半径大小比较正确的是:
A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S D.Ca<Rb<K<Na
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是:
A.1.5mol/(L·min) B.0.15mol/(L·min)
C.0.75mol/(L·min) D.0.075mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为____________________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
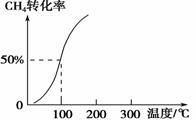 ①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4) 写出甲醇-空气-KOH溶液的燃料电池负极的电极反应式:______________________。
 (5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式________。
②写出除去甲醇的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水的电离达到平衡:H2O H++OH—;ΔH>0,下列叙述正确的是
H++OH—;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com