
【题目】要使偏铝酸钠溶液中的铝元素完全转化成Al(OH)3沉淀,选用的最佳试剂是
A.NaOH溶液B.稀盐酸C.氨水D.CO2
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】氯化亚硝酰(NOCl)具有强氧化性,易与水反应生成HCl和氮氧化物。实验室可通过反应Cl2+2NO![]() 2NOCl △H<0制备
2NOCl △H<0制备
回答下列问题:
(1)甲组同学拟用下图所示装置(夹持仪器未画出)拟制备Cl2和NO。

①制取Cl2时,分液漏斗中加入浓盐酸,则烧瓶中放入的固体药品可能是______。
②制取NO时,铜与稀硝酸反应的离子方程式为_________。
(2)乙组的同学制氯化亚硝酰(沸点为-5.5℃)的装置如下:
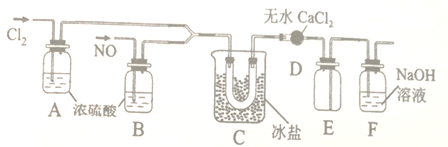
①装置D的作用是___________;装置E的作用是________。
②装置C中冰盐冷却的目的是___________(写两点)。
(3)丙组依据文献记载,氯化亚硝酰也可用NaNO2固体与气体制备,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铜与浓硫酸反应的实验说法不正确的是

A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,已知:NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2![]() ,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和
,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和![]() 。其一种生产工艺如下。
。其一种生产工艺如下。

请回答下列问题:
(1)NaClO2中![]() 的化合价为_____________。
的化合价为_____________。
(2)反应I:
①![]() 做___________(填“氧化剂”或“还原剂”)。
做___________(填“氧化剂”或“还原剂”)。
②将反应I中的化学方程式补充完整:
![]() _____________
_____________
(3)电解II:
①所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的![]() 和
和![]() ,需要加入的试剂分别为_______、___________。
,需要加入的试剂分别为_______、___________。
②电解过程中被氧化的物质是________。
③可用![]() 溶液吸收电解产生的
溶液吸收电解产生的![]() ,该反应的离子方程式是______________。
,该反应的离子方程式是______________。
(4)操作III:
滤液获利NaClO2的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得C1O2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是
A. 在反应中H2C2O4既不是氧化剂也不是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 1 mol KClO3参加反应有2 mol电子转移
D. KClO3在反应中是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甘氨酸(H2N-CH2-COOH)性质的说法中正确的是
A. 只有酸性,没有碱性B. 只有碱性,没有酸性
C. 既有酸性,又有碱性D. 既没有酸性,又没有碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com