
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶性金属氢氧化物在不同pH下的溶解度[S(mol·L-1)]如图所示。
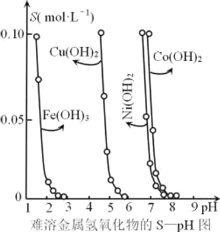
(1)pH=6时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是_____(选填序号)。
A.<2 B. 3.54.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,_______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______.
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为______.
已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的______(选填序号)。
A.NaOH B.FeS C.Na2S
【答案】Cu(OH)2 B 不能 Ni2+与Co2+沉淀完全时的pH相差很小 ![]() B
B
【解析】
1)在pH=6时,溶液中不会出现Cu(OH)2沉淀;
(2)除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右;
(3)Co2+和Ni2+沉淀的pH范围相差太小;
(4)根据反应物和生成物可写出反应的方程式;
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子。
(1)由图可知,在pH=6时,溶液中出现Cu(OH)2沉淀,主要以Cu(OH)2存在,
故答案为:Cu(OH)2;
(2)除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右Fe3+沉淀完全,
故答案为:B;
(3)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,无法控制溶液的pH,
故答案为:不能;Ni2+与Co2+沉淀完全时的pH相差很小;
(4)氢氧化铜沉淀溶于氨水生成![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子,
故答案为:B。


科目:高中化学 来源: 题型:
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是
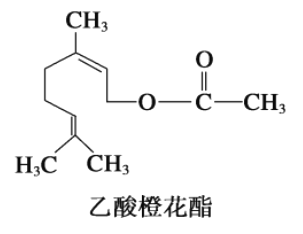
① 在Ni催化条件下1mol该有机物可与3mol H2发生加成;
② 该有机物不能发生银镜反应;
③ 该有机物分子式为C12H22O2;
④ 该有机物的同分异构体中不可能有酚类;
⑤ 1 mol该有机物水解时只能消耗1 mol NaOH
A. ②③④ B. ①④⑤ C. ②④⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是_________;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体__________克;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应;
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是___________,其物质的量之比是_____________;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68克.经分析,原溶液中的Cu2+有20%残留在母液中.求所得晶体的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温密闭容器中制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)﹣Q,达到平衡后,以下分析正确的是( )
A.加入硫酸镁固体,平衡正向移动
B.达到平衡时,气体的平均分子量保持不变
C.保持体积不变,充入CO,达到平衡的过程中逆反应速率逐渐增大
D.1mol MgSO4和1mol CO反应,达到平衡时吸收热量为Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、NO3-等共存物的存在会影响水体修复效果。定义单位时间内ZVI释放电子的物质的量为n1,其中用于有效腐蚀的电子的物质的量为n2。下列说法正确的是
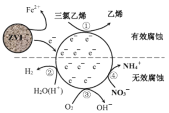
A.反应①在负极发生,②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时 n1=amol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使n1、n2均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是
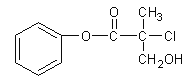
A.1mol A最多能与4mol H2发生加成反应
B.有机物A可以在一定条件下与HBr发生反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)+Q1 K1 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g)+Q2 K2 (Ⅱ)
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用含K1、K2的代数式表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡.测得在10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1,则平衡后n(Cl2)=_____mol,NO的转化率а1=____.其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а2____а1(填“>”“<”或“=”),平衡常数K2____(填“增大”“减小”或“不变”).若要使K2减小,可采用的措施是____.
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为____.(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1,可使溶液A和溶液B的pH相等的方法是____.
a 向溶液A中加适量水 b 向溶液A中加适量NaOH
c 向溶液B中加适量水 d 溶液B中加适量NaOH.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com