
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、NO3-等共存物的存在会影响水体修复效果。定义单位时间内ZVI释放电子的物质的量为n1,其中用于有效腐蚀的电子的物质的量为n2。下列说法正确的是
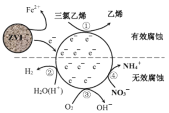
A.反应①在负极发生,②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时 n1=amol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使n1、n2均增大
【答案】CD
【解析】
A.由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所以应在正极发生,故A错误;
B.三氯乙烯C2HCl3中C原子化合价为+1价,乙烯中C原子化合价为-2价,1molC2HCl3转化为1molC2H4时,得到6mol电子,脱去3mol氯原子,所以脱去amolCl时ne = 2a mol,故B错误;
C.由示意图及N元素的化合价变化可写出如下转化![]() ,由于生成物中有
,由于生成物中有![]() ,所以只能用H+和H2O来配平该反应,而不能用H2O和OH-来配平,所以④的电极反应式为
,所以只能用H+和H2O来配平该反应,而不能用H2O和OH-来配平,所以④的电极反应式为![]() ,故C正确;
,故C正确;
D.增大单位体积水体中小微粒ZVI的投入量,可以增大小微粒ZVI和正极的接触面积,加快ZVI释放电子的速率,可使n1、n2增大,故D正确;
故答案为:CD。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】硫化钠是一种重要的化工原料.工业上用硫酸钠来制得硫化钠.制备硫化钠的反应原理为:Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)﹣Q,已知该可逆反应在1000℃时达到平衡,并保持反应器内恒温恒容.试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为______,若只改变一个影响因素,当平衡移动时,K值______变化(填“一定”或“不一定”);当K值变大时,逆反应速率______.(填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说法错误的是______.
a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe3O4固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为______.
(4)往Ba(ClO)2溶液中通入足量SO2气体后,溶液中的溶质是______.
(5)向亚硫酸钠中滴加酚酞,溶液变为红色,若在该溶液中再滴入过量的BaCl2溶液,现象是______,请结合离子方程式,运用平衡原理进行解释:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3则生成Fe2O3。据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) + 6H2(g)-Q
2Fe(s) + 3CO(g) + 6H2(g)-Q
(1)原子序数为26的铁元素位于元素周期表的第________周期__________族。
(2)反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g。则该段时间内H2的平均反应速率为____________________。
(3)将固定质量的Fe2O3(s)和CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是__________________。
A、CH4的转化率等于CO的产率
B、混合气体的平均相对分子质量不变
C、v正(CO):v逆(H2)=1︰2
D、固体的总质量不变
(4)FeO可用CO进行还原,已知:t℃时, FeO(s) +CO(g) ![]() Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
(5)Fe2O3还可用来制备FeCl3 ,FeCl3在水溶液中的水解分三步:
Fe3+ + H2O![]() Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O![]() Fe(OH)2+ + H+ K2
Fe(OH)2+ + H+ K2
Fe(OH)2+ + H2O![]() Fe(OH)3 + H+ K3
Fe(OH)3 + H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是____________________。
(6)通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O![]() Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
A、加水稀释 B、加入少量NaCl固体
C、升温 D、加入少量Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.锌与稀硫酸反应时,加入少量CuSO4溶液可以使反应速率加快
B.将NaOH和氨水溶液各稀释一倍,两者的c(OH-)均减小到原来的![]()
C.某反应的△H=+100 kJ·mol-1,则正反应的活化能比逆反应的小100 kJ/mol
D.用电解法精炼铜时,用粗铜块作为电解槽的阴极,纯铜片作为电解糟的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可消除NO的污染,反应方程式为:6NO+4NH3→5N2+6H2O.现有NO与NH3的混合物1mol充分反应,若还原产物比氧化产物多1.4g.则下列判断中正确的是( )
A.产生氮气为5.6 L
B.有0.3 mol NO被还原
C.生成氧化产物2.8 g
D.原混合物中NO与NH3的物质的量之比可能为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶性金属氢氧化物在不同pH下的溶解度[S(mol·L-1)]如图所示。
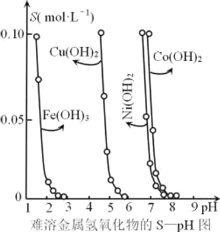
(1)pH=6时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是_____(选填序号)。
A.<2 B. 3.54.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,_______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______.
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为______.
已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的______(选填序号)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCl2和NaHCO3按物质的量之比为1:2混合制成溶液,加热蒸干灼烧后得到的固体是( )
A.Mg(HCO3)2、NaClB.MgO、NaClC.MgCl2、Na2CO3D.MgCO3、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:
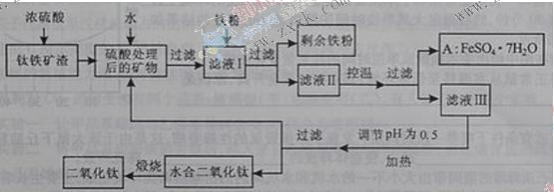
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是____________________________________。
(2)向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kg A(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为:![]()
(1)该有机物中所含官能团的名称是________________,________________。
(2)该有机物发生加聚反应后,所得产物的结构简式为__________________。
(3)写出该有机物使溴水褪色的化学方程式____________________________。
(4)写出该有机物发生消去反应的化学方程式(注明反应条件)_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com