
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3则生成Fe2O3。据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) + 6H2(g)-Q
2Fe(s) + 3CO(g) + 6H2(g)-Q
(1)原子序数为26的铁元素位于元素周期表的第________周期__________族。
(2)反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g。则该段时间内H2的平均反应速率为____________________。
(3)将固定质量的Fe2O3(s)和CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是__________________。
A、CH4的转化率等于CO的产率
B、混合气体的平均相对分子质量不变
C、v正(CO):v逆(H2)=1︰2
D、固体的总质量不变
(4)FeO可用CO进行还原,已知:t℃时, FeO(s) +CO(g) ![]() Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
(5)Fe2O3还可用来制备FeCl3 ,FeCl3在水溶液中的水解分三步:
Fe3+ + H2O![]() Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O![]() Fe(OH)2+ + H+ K2
Fe(OH)2+ + H+ K2
Fe(OH)2+ + H2O![]() Fe(OH)3 + H+ K3
Fe(OH)3 + H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是____________________。
(6)通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O![]() Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
A、加水稀释 B、加入少量NaCl固体
C、升温 D、加入少量Na2CO3固体
【答案】四 VIII 0.018mol(Lmin)-1 BCD 0.06 K1>K2>K3 ACD
【解析】
(1) Fe元素位于第四周期第VIII族;
(2) n(Fe2O3)=![]() ,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=
,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=![]() ,计算该段时间内氢气平均反应速率;
,计算该段时间内氢气平均反应速率;
(3)可逆反应达到平衡状态时,该物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(4)参加反应的n(FeO)=0.04mol×50%=0.02mol,根据方程式知,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=![]() , c(CO2)=0.02mol/L,化学平衡常数K=
, c(CO2)=0.02mol/L,化学平衡常数K=![]() =0.5,据此计算x值;
=0.5,据此计算x值;
(5)多元弱碱水解时,其第一步水解程度远远大于第二步,第二步水解程度远远大于第三步;
(6)欲使平衡正向移动,可以采用加入和氢离子反应的物质、加水稀释、升高温度的方法。
(1)Fe元素位于第四周期第VIII族,故答案为:四;VIII;
(2) n(Fe2O3)=![]() ,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=
,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=![]() ,故答案为:0.018mol(Lmin)1;
,故答案为:0.018mol(Lmin)1;
(3)A. CH4的转化率等于CO的产率时,该反应不一定达到平衡状态,A项错误;
B. 混合气体的平均相对分子质量不变时,各物质的物质的量不变,该反应达到平衡状态,B项正确;
C. v正(CO):v逆(H2)=1:2时,同一物质的正逆反应速率相等,该反应达到平衡状态,C项正确;
D. 固体的总质量不变时,该反应达到平衡状态,故正确;故答案为:BCD;
(4) 参加反应的n(FeO)=0.04mol×50%=0.02mol,根据方程式知,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=![]() , c(CO2)=0.02mol/L,化学平衡常数K=
, c(CO2)=0.02mol/L,化学平衡常数K=![]() =0.5解得x=0.06,故答案为:0.06;
=0.5解得x=0.06,故答案为:0.06;
(5)多元弱碱水解时,因为每一步水解都生成氢离子,氢离子的存在抑制水解,所以其第一步水解程度远远大于第二步,第二步水解程度远远大于第三步,则存在K1>K2>K3,故答案为:K1>K2>K3;
(6)欲使平衡正向移动,可以采用加入和氢离子反应的物质、加水稀释、升高温度的方法,故选ACD,故答案为:ACD。


科目:高中化学 来源: 题型:
【题目】汽车尾气产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是

A.曲线b对应的条件改变可能是加入了催化剂
B.温度T下,随着反应的进行,混合气体的密度减小
C.温度T下,该反应的平衡常数K =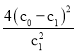
D.若曲线b对应的条件改变是温度,可判断该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验现象叙述错误的是( )
A.硫蒸汽与H2混合生成H2S
B.NH3使含酚酞的水溶液变红,加热后又恢复到无色
C.NH4Cl固体受热会发生升华
D.浓硝酸久置后颜色会变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验分析不正确的是( )
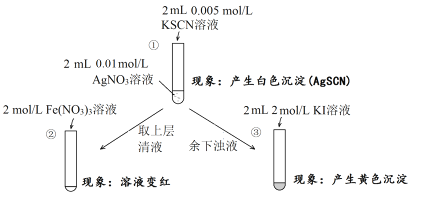
A.①浊液中存在平衡:AgSCN(s) ![]() Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是
A.氢氧化铝的酸式电离:Al(OH)3+H2O[Al(OH)4] —+H+
B.铜与稀硝酸的反应:Cu+4H++NO3—= Cu2+ + NO2+H2O
C.将去膜的铝片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2—的存在:2NO2—+2I—+4H+=2NO↑+I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是_________;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体__________克;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应;
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是___________,其物质的量之比是_____________;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68克.经分析,原溶液中的Cu2+有20%残留在母液中.求所得晶体的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)28H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可知( )
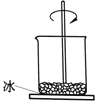
A.该反应中,化学能转变成热能
B.反应物的总能量低于生成物的总能量
C.氯化铵与氢氧化钡的反应为放热反应
D.反应的热化学方程式为 2NH4Cl+Ba(OH)2→BaCl2+2NH3H2O﹣Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、NO3-等共存物的存在会影响水体修复效果。定义单位时间内ZVI释放电子的物质的量为n1,其中用于有效腐蚀的电子的物质的量为n2。下列说法正确的是
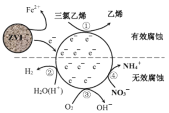
A.反应①在负极发生,②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时 n1=amol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使n1、n2均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com