
【题目】下列反应的离子方程式书写不正确的是
A.氢氧化铝的酸式电离:Al(OH)3+H2O[Al(OH)4] —+H+
B.铜与稀硝酸的反应:Cu+4H++NO3—= Cu2+ + NO2+H2O
C.将去膜的铝片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2—的存在:2NO2—+2I—+4H+=2NO↑+I2+2H2O
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置制备一硝基甲苯
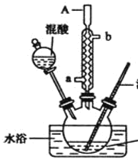 甲苯
甲苯
已知.30℃左右主要产物为一硝基甲苯,温度过高时会生成二硝基甲苯和三硝基甲苯。
实验步骤如下.
①配制浓硫酸和浓硝酸(按体积比1.3)的混合物(混酸)
②在三颈瓶里装15ml甲苯
③装好其它药品,并组装好仪器
④向三颈烧瓶中加入混酸,并不断搅拌
⑤控制温度,大约反应10min至三颈烧瓶底有大量液体(淡黄色油状)出现
⑥分离出一硝基甲苯。(已知.甲苯的密度为0.866g/ml,沸点为110.6℃,硝基苯的密度为1.20g/ml,沸点为210.9℃)
根据上述实验,回答下列问题
(1)实验方案中缺少一个必要的仪器,它是___________。本实验的关键是控制温度在30℃左右在,如果温度过高,产生的后果是_____________________________________。
(2)简述配制混酸的方法_______________________________________________________,浓硫酸的作用是______________________________。
(3)A仪器的名称是_________________进水口是________________。
(4)写出甲苯与混酸反应生成间硝基甲苯的化学方程式___________________________。
(5)分离产品方案如图所示

操作2的名称是_________________。
(6)经测定,产品1为一硝基甲苯,其核磁共拜氢谱中有3个峰,则其结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11P4+60CuSO4+96H2O = 20Cu3P+24H3PO4+60H2SO4中,1molCuSO4能氧化白磷(P4)的物质的量是
A.1/10molB.1/20molC.11/20molD.1/12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)俗称保险粉,可用作照相定影剂、纸浆漂白脱氯剂等。
实验室可通过反应2Na2S+Na2CO3+4SO2→3Na2S2O3+CO2制取Na2S2O3,装置如图所示。
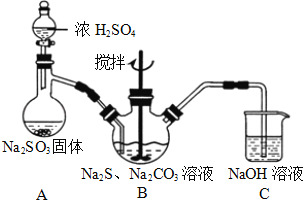
(1)装置B中搅拌器的作用是______;装置C中NaOH溶液的作用是_____。
(2)请对上述装置提出一条优化措施_______________________。
为测定所得保险粉样品中Na2S2O35H2O的质量分数,称取3.000g Na2S2O35H2O样品配成100mL溶液,用0.100mol/L标准碘溶液进行滴定,反应方程式为:2Na2S2O3+I2→2NaI+Na2S4O6
(3)滴定时用__________作指示剂,滴定时使用的主要玻璃仪器有________________。
(4)滴定时,若看到溶液局部变色就停止滴定,则样品中Na2S2O35H2O的质量分数测定值__________(填“偏高”、“偏低”或“不变”)。
(5)某学生小组测得实验数据如下:
实验次数 | 样品溶液体积(ml) | 滴定消耗0.100mol/L碘溶液体积(ml) |
1 | 20.00 | 9.80 |
2 | 20.00 | 10.70 |
3 | 20.00 | 9.90 |
该样品中Na2S2O35H2O的质量分数是_______。(精确到0.001)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 固体表面水膜的酸性很弱或呈中性,发生吸氧腐蚀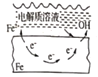
B. 钢铁表面水膜的酸性较强,发生析氢腐蚀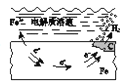
C. 将锌板换成铜板对钢闸门保护效果更好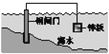
D. 钢闸门作为阴极而受到保护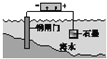
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3则生成Fe2O3。据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) + 6H2(g)-Q
2Fe(s) + 3CO(g) + 6H2(g)-Q
(1)原子序数为26的铁元素位于元素周期表的第________周期__________族。
(2)反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g。则该段时间内H2的平均反应速率为____________________。
(3)将固定质量的Fe2O3(s)和CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是__________________。
A、CH4的转化率等于CO的产率
B、混合气体的平均相对分子质量不变
C、v正(CO):v逆(H2)=1︰2
D、固体的总质量不变
(4)FeO可用CO进行还原,已知:t℃时, FeO(s) +CO(g) ![]() Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
(5)Fe2O3还可用来制备FeCl3 ,FeCl3在水溶液中的水解分三步:
Fe3+ + H2O![]() Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O![]() Fe(OH)2+ + H+ K2
Fe(OH)2+ + H+ K2
Fe(OH)2+ + H2O![]() Fe(OH)3 + H+ K3
Fe(OH)3 + H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是____________________。
(6)通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O![]() Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
A、加水稀释 B、加入少量NaCl固体
C、升温 D、加入少量Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0,下列措施中,既能使正反应速率增大又能使平衡正向移动的是
2SO3(g) △H<0,下列措施中,既能使正反应速率增大又能使平衡正向移动的是
A.通入大量的SO2B.增大容积的体积
C.移去部分SO3D.升高体系的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可消除NO的污染,反应方程式为:6NO+4NH3→5N2+6H2O.现有NO与NH3的混合物1mol充分反应,若还原产物比氧化产物多1.4g.则下列判断中正确的是( )
A.产生氮气为5.6 L
B.有0.3 mol NO被还原
C.生成氧化产物2.8 g
D.原混合物中NO与NH3的物质的量之比可能为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知相同温度下CH3COOH和NH3H2O的电离常数相等,现向10mL浓度为0.1molL﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH4+):c(NH3H2O)始终减小
C.c(CH3COOH)与c(CH3COO)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com