
【题目】NH3可消除NO的污染,反应方程式为:6NO+4NH3→5N2+6H2O.现有NO与NH3的混合物1mol充分反应,若还原产物比氧化产物多1.4g.则下列判断中正确的是( )
A.产生氮气为5.6 L
B.有0.3 mol NO被还原
C.生成氧化产物2.8 g
D.原混合物中NO与NH3的物质的量之比可能为3:2
【答案】BC
【解析】
6molNO还原得到3molN2,4molNH3氧化得到2molN2,两者相差1molN2,现相差1.4g,![]() =0.05mol,相当于0.3molNO和0.2molNH3反应,产生氮气0.25mol;依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,所以有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO;
=0.05mol,相当于0.3molNO和0.2molNH3反应,产生氮气0.25mol;依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,所以有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO;
A.如是标准状况下,则V(N2)=0.25mol×22.4L/mol=5.6L,但气体存在的条件未知,不能确定气体的体积,故A错误;
B.由以上分析可知,有0.3 mol NO被还原,故B正确;
C.0.2molNH3反应,被氧化生成氮气,则氧化产物为0.1mol,质量为2.8 g,故C正确;
D.气体有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO,二者比值不是3:2,故D错误。
故答案为BC。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是
A.氢氧化铝的酸式电离:Al(OH)3+H2O[Al(OH)4] —+H+
B.铜与稀硝酸的反应:Cu+4H++NO3—= Cu2+ + NO2+H2O
C.将去膜的铝片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2—的存在:2NO2—+2I—+4H+=2NO↑+I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)28H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可知( )
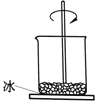
A.该反应中,化学能转变成热能
B.反应物的总能量低于生成物的总能量
C.氯化铵与氢氧化钡的反应为放热反应
D.反应的热化学方程式为 2NH4Cl+Ba(OH)2→BaCl2+2NH3H2O﹣Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应CO(g)+H2O (g)![]() CO2(g)+H2(g),△H>0,达到平衡状态后,分别改变某个条件,下面四个说法中,条件改变、影响原因、影响结果均正确的是
CO2(g)+H2(g),△H>0,达到平衡状态后,分别改变某个条件,下面四个说法中,条件改变、影响原因、影响结果均正确的是
条件改变 | 影响原因 | 影响结果 | |
A | 适当缩小容器的容积 | 活化分子所占百分比增大,正逆反应速率均同等程度加快 | 平衡不移动 |
B | 适当升高温度 | 活化分子所占百分比增大,正逆反应速率加快,逆反应速率减慢 | 平衡正向移动 |
C | 加入催化剂 | 分子能量增大,活化分子所占百分比增大,正逆反应速率均同等程度加快 | 平衡不移动 |
D | 适当扩大容器的容积 | 活化分子所占百分比不变,但是单位体积内的活化分子数减少,正逆反应速率同等程度减慢 | 平衡不移动 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、NO3-等共存物的存在会影响水体修复效果。定义单位时间内ZVI释放电子的物质的量为n1,其中用于有效腐蚀的电子的物质的量为n2。下列说法正确的是
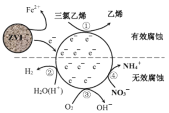
A.反应①在负极发生,②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时 n1=amol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使n1、n2均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .光气(COCl2)在塑料、制革、制药等工业上有许多用途。制备光气的方法很多, 下列两种方法常用。
(1)方法一:工业上制备光气的原理:CO+Cl2![]() COCl2,其中原料气CO可利用天然气在氧气中不完全燃烧生产,已知:
COCl2,其中原料气CO可利用天然气在氧气中不完全燃烧生产,已知:
CH4(g)+2O2(g) =CO2(g)+2H2O(1) △H = - 890.3 kJ·mol-1
2CO(g)+O2(g)= 2CO2(g) △H =-566 kJ·mol-1
每生产224LCO (标准状况)所放出的热量约为________ kJ。
(2)方法二:实验室可用氯仿(CHCl3)与双氧水反应制备光气,同时还有一种酸性溶液生成。写出实验室制备光气的化学方程式__________。
II.COCl2 的分解反应为:COCl2(g)![]() Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示(第l0min到14 min的COCl2浓度变化曲线未画出):
Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示(第l0min到14 min的COCl2浓度变化曲线未画出):
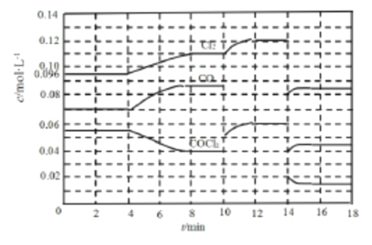
(3)先计算第8 min时CO的浓度,再计算平衡数K=________。
(4)比较第2 min反应温度与第8 min反应温度T8的高低:T2_____T8(选填“ >”、“< ”或“=”)。
(5)若12 min时反应于温度T8下重新达到平衡,则此时c(COCl2)=_____mol·L-1(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝粉和某铁的氧化物(xFeO·yFe2O3)粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5 : 7,则x : y为
A.1∶1B.1∶2C.5∶7D.7∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com