
| A.任何化学反应都伴随着能量的变化 |
| B.1 mol H2SO4和 1 mol Ba(OH)2完全反应所放出的热量称为中和热 |
| C.在101kPa 时,1 mol 碳燃烧放出的热量就是碳的燃烧热 |
| D.在化学反应中需要加热的反应就是吸热反应 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:单选题
| A.该过程为物理变化 | B.金刚石比石墨硬度大 |
| C.石墨比金刚石稳定 | D.石墨金刚石不能互相转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1 CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1 CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 N2(g) + 2 CO2(g) △H = kJ/mol。
N2(g) + 2 CO2(g) △H = kJ/mol。 2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
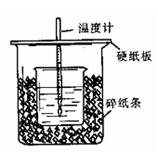
| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | | 27.3 | |
| 2 | 25 | 25 | | 27.4 | |
| 3 | 25 | 25 | | 28.6 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 中错误的是
中错误的是 21
21| A.中和反应是放热反应 | B.油脂在人体中氧化是放热反应 |
| C.镁与盐酸反应是吸热反应 | D.氢分子(H-H)变成2个H需吸收能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2与F2反应的热化学方程式为:H2(g) + F2(g) = 2HF(g)△H =" -541" kJ |
| B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com