
 CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1 CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1 CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
科目:高中化学 来源:不详 题型:单选题
| A.1,3-环己二烯比苯稳定 |
| B.苯比1,3-环己二烯稳定 |
| C.1,3-环己二烯加氢是吸热反应 |
| D.苯与氢气加成生成环己烷是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO (g)+ 6H2O(g)
4NO (g)+ 6H2O(g)
| A.由图可知,该反应的正反应是吸热反应 |
| B.升高温度可以提高NH3的转化率 |
| C.反应体系中加入催化剂可增加反应热 |
| D.将平衡混合物通入水中一定有硝酸铵生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题





查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K= ▲ 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K= ▲ 。(计算结果保留小数点后两位数字) 
 N2(g)+O2(g)为(填“吸热”或“放热”) ▲ 反应。
N2(g)+O2(g)为(填“吸热”或“放热”) ▲ 反应。 N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。
N2(g)+O2(g) 已达到平衡的是(填序号)▲ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量。”(已知煤炭的燃烧热为-393.15 kJ/mol,氢气的燃烧热为-242 kJ/mol,一氧化碳的燃烧热为-283 kJ/mol)
因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量。”(已知煤炭的燃烧热为-393.15 kJ/mol,氢气的燃烧热为-242 kJ/mol,一氧化碳的燃烧热为-283 kJ/mol)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.对于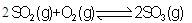  (Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ (Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ |
| B.热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 |
| C.需要加热才能发生的反应不一定是吸热反应 |
D.小苏打在水中的电离方程式: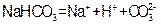 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.任何化学反应都伴随着能量的变化 |
| B.1 mol H2SO4和 1 mol Ba(OH)2完全反应所放出的热量称为中和热 |
| C.在101kPa 时,1 mol 碳燃烧放出的热量就是碳的燃烧热 |
| D.在化学反应中需要加热的反应就是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com