
【题目】一种常用融雪剂的主要成分的化学式为XY2,X原子的结构示意图为![]() ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-=2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是________________________________。
【答案】20 CaCl2硫碳BB、D水分子间存在氢键
【解析】
(1)X原子的结构示意图![]() ,根据核外电子排布规律,a=2,b=8,可推知其为
,根据核外电子排布规律,a=2,b=8,可推知其为![]() ,该元素为Ca,m=20,根据CaY2可知Y为-1价,又因为Y-与Ca2+的电子层结构相同,可知Y为Cl;(2)Z、W原子的最外层电子数是其电子层数的2倍,则Z、W是C或S,Z与Y相邻,则Z是S,W是C,名称分别是硫和碳;(3)A、CaCl2是仅含离子键的离子化合物,CS2是仅含极性键的共价化合物,故A错误;B、根据A选项的分析,故B正确;C、S的非金属性弱于Cl,则H2S的稳定性比HCl弱,故C错误;D、Ca2+、Cl-具有相同的电子层结构,但Ca2+的核电荷数大,离子半径小,故D错误;(4)A、XY2为CaCl2,其电子式为
,该元素为Ca,m=20,根据CaY2可知Y为-1价,又因为Y-与Ca2+的电子层结构相同,可知Y为Cl;(2)Z、W原子的最外层电子数是其电子层数的2倍,则Z、W是C或S,Z与Y相邻,则Z是S,W是C,名称分别是硫和碳;(3)A、CaCl2是仅含离子键的离子化合物,CS2是仅含极性键的共价化合物,故A错误;B、根据A选项的分析,故B正确;C、S的非金属性弱于Cl,则H2S的稳定性比HCl弱,故C错误;D、Ca2+、Cl-具有相同的电子层结构,但Ca2+的核电荷数大,离子半径小,故D错误;(4)A、XY2为CaCl2,其电子式为![]() ,故A错误;B、WZ2为CS2,其空间结构类似与CO2,因此其结构式为S=C=S,故B正确;C、Y的单质为Cl2,H2Z为H2S,因为氯气的氧化性强于S,因此发生Cl2+H2S=2HCl+S↓,H2S的水溶液为弱酸,应写成分子式,即Cl2+H2S=2H++2Cl-+S↓,故C错误;D、CaCl2为离子化合物,根据CaCl2的电子式,故D正确;(5)H2O分子间存在氢键,H2S分子间不存在氢键,存在分子氢键物质的熔沸点高于不含有分子间的氢键的,故水的沸点高于H2S。
,故A错误;B、WZ2为CS2,其空间结构类似与CO2,因此其结构式为S=C=S,故B正确;C、Y的单质为Cl2,H2Z为H2S,因为氯气的氧化性强于S,因此发生Cl2+H2S=2HCl+S↓,H2S的水溶液为弱酸,应写成分子式,即Cl2+H2S=2H++2Cl-+S↓,故C错误;D、CaCl2为离子化合物,根据CaCl2的电子式,故D正确;(5)H2O分子间存在氢键,H2S分子间不存在氢键,存在分子氢键物质的熔沸点高于不含有分子间的氢键的,故水的沸点高于H2S。


科目:高中化学 来源: 题型:
【题目】-Fe2O3是一种具有磁性、催化等作用的纳米材料,以硫铁矿烧渣等为原料生产制备-Fe2O3的流程如下:
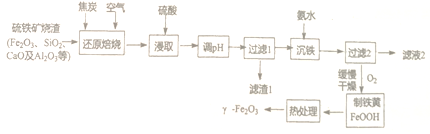
已知:“还原焙烧”的主要反应为:3C+2O2![]() 3CO↑+CO2↑,Fe2O3+CO
3CO↑+CO2↑,Fe2O3+CO![]() 2FeO + CO2
2FeO + CO2
回答下列问题:
(1)“浸取”前需将焙烧生成的混合物粉碎,其目的是_____________________。
(2)“滤渣1”除了CaSO4外还有_______________。
(3)常温下Ksp[Al(OH)3]=1.3×10-33。当常温下溶液pH=6时,c(Al3+)=____________。
(4)“过滤2”时需用蒸馏水洗涤,能证明己洗涤干净的方法是______________;
(5)沉淀缓慢氧化为铁黄的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓硝酸中放入铜片:
(1)反应开始的化学方程式为_________________________________________;
(2)根据上述实验现象,表明硝酸具有_____________填序号;
①酸性 ②不稳定性 ③强氧化性
(3)用V L的试管装满NO2气体,并倒扣在足量的水中,待试管中液面不再上升时,试管中溶液的浓度为_____________;(气体摩尔体积用Vm表示)
(4)待反应停止时,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是________________________________________离子方程式;
(5)若将12.8g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6L标准状况,则所消耗的硝酸的物质的量是_____________,反应中转移的电子的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________(用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________(填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________(填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________(填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________(填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________(填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
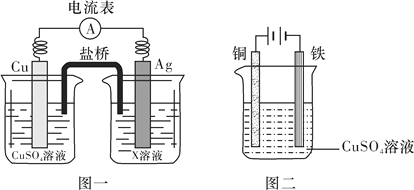
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________(填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
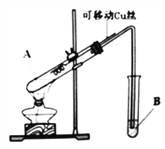
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。

已知:
①E能发生银镜反应,在一定条件下,1 mol E能与2 mol H2反应生成F;
②R—CH===CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B________________;
(2)E的结构简式为__________________________;
(3)C与新制Cu(OH)2反应的化学方程式为____________________________;
(4)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种,写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式____________________;
(5)以丙烯等为原料合成D的路线如下:

X的结构简式为_______,步骤Ⅱ的反应条件为___________,步骤Ⅳ的反应类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素![]() )等。每100克黑木耳含铁高达185毫克。
)等。每100克黑木耳含铁高达185毫克。
ii.紫色的![]() 溶液在酸性条件下具有强氧化性,其还原产物是无色的
溶液在酸性条件下具有强氧化性,其还原产物是无色的![]() 。
。
I:为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
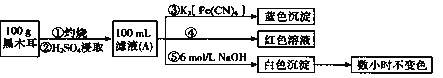
(1)步骤②得到滤液A的操作是_________。
(2)步骤④检验![]() 所用试剂是_________溶液。
所用试剂是_________溶液。
(3)下列有关上述实验得出的结论是_____(填字母符号)。
a.黑木耳中一定含![]() 和
和![]()
b.滤液A中一定含![]() 和
和![]()
c.白色沉淀中一定含![]()
II:为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
![]()
(4)可选作试剂B的物质是__________(填字母序号)
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
(5)步骤⑦中观察到的实验现象是_________,反应的离子方程式是____________。
(6)若同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

(1)试管中发生反应的化学方程式为_______________________________。
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是________(只有一个选项符合题意),若溶液未变红,则试管中固体是________(只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,原因是: __________________________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关反应的化学方程式__________________________________________________,______________________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色。由此可知,实验室FeCl2溶液需现用现配的原因是___________________________________,并且配制时应加入少量________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com