
【题目】根据碘与氢气反应的热化学方程式(1)I2(g)+ H2(g) ![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
(2)I2(s)+ H2(g) ![]() 2HI(g) ΔH=+26.48 kJ/mol,下列判断正确的是
2HI(g) ΔH=+26.48 kJ/mol,下列判断正确的是
A. 254 g I2(g)中通入2 gH2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(2)的反应物总能量比反应(1)的反应物总能量低
D. 反应(1)的产物比反应(2)的产物稳定
【答案】C
【解析】
试题n(I2)= 254 g÷254 g/mol=1mol;n(H2)=" 2" g÷2 g/mol=1mol, n(I2): n(H2)=1:1,符合方程式中的物质的量的比,但由于该反应为可逆反应,所以不可能完全反应,所以反应放出的热量小于9.48 kJ。错误。B.由题目给定的两个热化学方程式可知:1 mol固态碘与1 mol气态碘所含的能量相差(26.48 +9.48) kJ = 35.96 kJ.错误。C.两个反应的生成物的总能量相同,而反应物的总能量前者大于后者,所以反应(2)的反应物总能量比反应(1)的反应物总能量低。正确。D.同种物质能量越低越温度。而反应(1)的产物与反应(2)的产物状态相同,所以稳定性也相同。错误。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
B. c(NH4+)/c(NH3·H2O)先增大再减小
C. 水的电离程度始终增大
D. c(CH3COOH)与c(CH3COO-)之和始终保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(g)![]() pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
A. 平衡向逆反应方向移动B. A的转化率降低
C. m+n>pD. C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中不正确的是( )
2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中不正确的是( )
A. 升高温度会使反应速率加快
B. 当NH3的浓度不再变化时,反应达到了平衡状态
C. 在高温和催化剂作用下,H2可以100%地转化为NH3
D. 使用催化剂可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
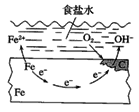
A. 铁片里的铁和碳与食盐水形成无数的微小原电池
B. 铁电极发生氧化反应
C. 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D. 放置一段时间后,铁片上有铁锈出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是按原子序数由小到大排列的前20号元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(部分产物未列出):

(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是
。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 7.2×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:___________。
(4)已知pH= -lgc(H+),体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______醋酸的电离平衡常数(填“>”、“<”或“=”)。 任意写一种方法证明醋酸是弱电解质________________。

(5)向 0.l molL-1 HF 溶液中滴加 NaOH 溶液至c(HF) : c(F-) =5 : 36,此时溶液pH = _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁酸乙酯广泛应用于食用香精配方中,可调配多种果香型香精。实验室制备丁酸乙酯的反应、装置示意图(如图)和有关数据如下:
密度/(g/cm3) | 沸点/℃ | 水中溶解性 | |
正丁酸 | 0.9587 | 163 | 溶 |
丁酸乙酯 | 0.877 | 121 | 难溶 |

实验步骤:在A中加入10.0g的乙醇、8.80g的丁酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集120~123℃馏分,得丁酸乙酯4.80g。
回答下列问题:
(1)仪器B中,冷凝水从_____(填“a”或“b”)口进。
(2)在洗涤操作中,第一次水洗的主要目的是____,饱和碳酸氢钠溶液的作用是____,第二次水洗的主要目的是_____。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填序号)。
a.直接将丁酸乙酯从分液漏斗的上口倒出
b.先将水层从分液漏斗的下口放出,再将丁酸乙酯从下口放出
c.直接将丁酸乙酯从分液漏斗的下口放出
d.先将水层从分液漏斗的下口放出,再将丁酸乙酸从上口倒出
(4)实验中加入过量乙醇的目的是_________。
(5)实验中加入少量无水MgSO4的目的是________。
(6)本实验的产率是____(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com