
(1)环境专家认为可以用金属铝将水体中的NO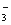 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO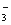 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:①4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
②Fe2O3(s)+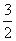 C(s)=
C(s)= 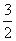 CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图: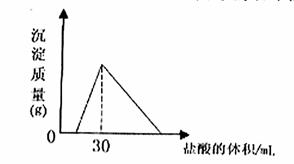 则反应过程中产生氢气的总体积为 L(标准状况)
则反应过程中产生氢气的总体积为 L(标准状况)
【知识点】离子方程式 反应热 电化学 计算 A 2B1 F3 F2
【答案解析】
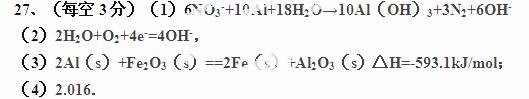
解析:⑴根据金属铝将水体中的NO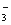 转化为N2,及该反应中涉及的粒子有:H2O、Al、OH
转化为N2,及该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO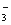 、N2,知反应物有Al、NO
、N2,知反应物有Al、NO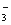 ,生成物有Al(OH)3、N2,并根据得失电子配平:6NO3-+10Al→10Al(OH)3+3N2,再根据电荷守恒知生成物还有OH
,生成物有Al(OH)3、N2,并根据得失电子配平:6NO3-+10Al→10Al(OH)3+3N2,再根据电荷守恒知生成物还有OH ,根据原子守恒知反应物还有水,6NO3-+10Al +18H2O=10Al(OH)3+3N2+6OH-
,根据原子守恒知反应物还有水,6NO3-+10Al +18H2O=10Al(OH)3+3N2+6OH-
⑵根据总反应4Al+3O2+6H2O=4Al(OH)3知电池正极的电极反应式为2H2O+O2+4e-=4OH-
⑶根据盖斯定律:①÷2+②-③×3/2得2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ/mol
⑷根据图像可知,盐酸加到30mL时,沉淀达最大,此时溶液中只有氯化钠,根据n(NaCl)=n(HCl)=0.06mol,则n(Na)=0.06mol,根据图像可知,氢氧化钠应该是过量的,过量的氢氧化钠是0.02L×1mol/L=0.02mol,则根据钠原子守恒知偏铝酸钠的物质的量为0.06mol-0.02mol=0.04mol,0.06mol钠与水反应生成氢气0.03mol,生成0.04mol的偏铝酸钠的同时生成氢气0.06mol,即生成氢气共0.09mol,为2.016L。
【思路点拨】氧化还原反应的配平技巧:如本题的第⑴题的配平:首先根据氧化还原反应得失电子相等配平氧化剂、还原剂、氧化产物和还原产物,再根据电荷守恒确定右边却OH-,最后根据原子守恒配平;根据终态法结合守恒解计算题:即本题的盐酸加到30mL时,沉淀达最大,此时溶液中只有氯化钠,然后根据守恒法解。


科目:高中化学 来源: 题型:
I.某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1) 该反应中的还原剂是________。
(2) 该反应中,发生还原反应的过程是________→________。
(3) 写出该反应的化学方程式,并标出电子转移的方向和数目:
_____________________ __ 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
II.高锰酸钾在不同的条件下发生的反应如下:
MnO+5e-+8H+===Mn2++4H2O ①
MnO+3e-+2H2O===MnO2↓+4OH- ②
MnO+e-===MnO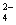 (溶液绿色) ③
(溶液绿色) ③
(1) 从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2) 将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
__________→___________。
(3) 将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________
a. 氧化性:PbO2>KMnO4
b. 还原性:PbO2>KMnO4
c. 该反应可以用盐酸酸化
(4) 将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):
① ________KMnO4+________K2S+______( )===________K2MnO4+________K2SO4+________S↓+______( )。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol•L-1。反应进行2min后A的浓度为0.8 mol•L-1,B的浓度为0.6 mol•L-1,C的浓度为0.6 mol•L-1。则2min内反应的平均速率υ(A)=____________, υ(B)=_________________,υ(C)=_______________。 该反应的化学反应方程式为:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl-、SO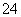 、CO
、CO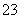 、NH
、NH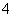 、Fe3+、Al3+和K+。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
、Fe3+、Al3+和K+。取该溶液 100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
A、至少存在5种离子 B、Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C、SO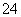 、NH
、NH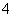 一定存在,Cl-可能不存在 D、CO
一定存在,Cl-可能不存在 D、CO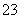 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.乙醇和乙酸都能与金属钠反应
B.淀粉水解的最终产物是氨基酸
C.植物油和动物脂肪都不能使溴水褪色
D.苯、乙烯都能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
可通过实验来验证淀粉水解可生成还原性糖,其实验包括下列一些操作过程,这些操作过程正确的顺序是:①取少量淀粉加水制成溶液 ②加热煮沸 ③加入碱液中和并呈碱性 ④加入新制Cu(OH)2悬浊液 ⑤加入几滴稀硫酸 ⑥再加热
A. ①②⑤⑥④③ B. ①⑤②④⑥③ C. ①⑤②③④⑥ D. ①⑥④⑤③②
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中: K+、Al3+、Cl-、SO42-
B.H+浓度为1×10-13mol·L-1的溶液中,Na+、K+、Cl-、NO3-
C.AlO2-浓度为0.1 mol·L-1的溶液中: Na+、K+、HCO3-、Cl-
D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SiO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
从对化合物分类方法出发,指出下列各组物质中与其他物质类型不同的一种物质。
A.Na2O、CaO、SO2、CuO________。
B.NaCl、KCl、NaClO3、CaCl2________。
C.HClO3、KClO3、HCl、NaClO3________。
D.NaHCO3、Ca(HCO3)2、NH4HCO3、K2CO3________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com