
I.ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr(OH)3��H2O��H2O2��
��֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2��O2��
��1�� �÷�Ӧ�еĻ�ԭ����________��
��2�� �÷�Ӧ�У�������ԭ��Ӧ�Ĺ�����________��________��
��3�� д���÷�Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ��
_____________________ __ ��
��4���練Ӧת����0.3mol���ӣ�������������ڱ�״�������Ϊ________��
II.��������ڲ�ͬ�������·����ķ�Ӧ���£�
MnO��5e����8H��===Mn2����4H2O����
MnO��3e����2H2O===MnO2����4OH������
MnO��e��===MnO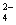 (��Һ��ɫ)����
(��Һ��ɫ)����
��1�� �����������뷴Ӧ�п��Կ�������������ӱ���ԭ�IJ�������Һ��________Ӱ�졣
��2�� ��SO2ͨ����������Һ�У�������ԭ��Ӧ�����ӷ�Ӧ����Ϊ
__________��___________��
��3�� ��PbO2Ͷ�뵽����MnSO4��Һ�н��裬��Һ��Ϊ�Ϻ�ɫ������˵����ȷ����________
a. �����ԣ�PbO2>KMnO4
b. ��ԭ�ԣ�PbO2>KMnO4
c. �÷�Ӧ�����������ữ
��4�� �����������μ��뵽����Һ�з������·�Ӧ������K2SO4��S�����ʵ���֮��Ϊ3��2, ������л�ѧ����ʽ����������ϵ���������������ʣ���
�� ________KMnO4��________K2S��______( )===________K2MnO4��________K2SO4��________S����______( )��
�� ������6.4g������Ӧ������ת�Ƶ��ӵ����ʵ���Ϊ________��
���𰸡����H2O2
��H2CrO4 Cr(OH)3
��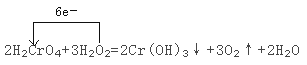
��3.36L
��������
��MnO4- Mn2+
��a
�Ȣ�28 5 24KOH 28 3 2 12H2O
��2.8mol
��������
���������
�������ϢH2O2-��O2�п�֪����Ԫ�صĻ��ϼ���-1�����ߵ�0����H2O2Ϊ��ԭ����
��������������ԭ��Ӧ����Ԫ�ػ��ϼ۽��͵�����Ϊ����������CrԪ�صĻ��ϼ۽��ͣ�����ԭ��Ӧ�Ĺ���ΪH2CrO4��Cr(OH)3��
�Ǹ÷�Ӧ����Ԫ��ʧ���ӣ�CrԪ�صõ����ӣ�2molH2CrO4��Ӧת�Ƶ���Ϊ2mol����6-3��=6mol������Ԫ�صõ�����Ϊ6mol����÷�Ӧ�ķ���ʽ������ת�Ƶķ������ĿΪ��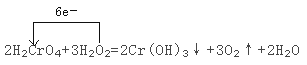 ��
��
����2H2CrO4+3H2O2�T2Cr��OH��3+3O2��+2H2O��֪������3mol����ת��6mol���ӣ���ת����0.3mol���ӣ����������������ʵ���Ϊ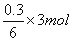 =0.15mol�����ڱ�״�������Ϊ0.15mol��22.4L/mol=3.36L��
=0.15mol�����ڱ�״�������Ϊ0.15mol��22.4L/mol=3.36L��
��Ÿ��������뷴Ӧ�п��Կ�������������ӱ���ԭ�IJ�������Һ����Ե�Ӱ�죻
��SO2ͨ����������Һ�У�SO2����ԭ����KMnO4����������������ԭ��Ӧ��MnO4-��Mn2+����
��PbO2Ͷ�뵽����MnSO4��Һ�н��裬��Һ��Ϊ�Ϻ�ɫ��Mn2+������������MnO4-����˵�������ԣ�PbO2>KMnO4����������ᱻ��������������ʸ÷�Ӧ�����������ữ��
�Ȣٸ�������÷�Ӧ������������K2SO4��S�����ݡ�K2SO4��S�����ʵ���֮��Ϊ3��2������Ӧ��K2SO4��S��ϵ��֮��Ϊ3��2��Ȼ���ٸ��ݵ�ʧ�����غ��ԭ���غ㽫����ƽΪ28KMnO4��5K2S��24KOH ===28K2MnO4��3K2SO4��2S��+12H2O��
�ڸ���������ƽ�ķ���ʽ�ɵõ�������ת�Ƶ�����֮��Ĺ�ϵΪ��2S��28e-����������6.4g��0.2mol��������Ӧ������ת�Ƶ��ӵ����ʵ���Ϊ2.8mol��
���㣺����������ԭ��Ӧԭ������ƽ�����㡣


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬ�¶��£�ͬ�ֹ�����Ƭ�ֱ����������ʻ�ϣ���ѧ��Ӧ���������ǣ�
A��0.1mol/L������15mL�� B��0.2mol/L������15mL
C��18mol/L��������Һ15mL�� D��0.15mol/L��������Һ8mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������Ͷ�뵽�ܽ������������ͭ����Һ�У���ַ�Ӧ��ʣ�������ĩ��������ԭ�������۵�������ȣ���ԭ��Һ��H+��SO42�������ʵ���Ũ��֮��Ϊ�� ����
A��1��4 B��2��7 C��1��2 D��3��8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����и���������ָ����Һ��һ���ܴ����������
A��ʹ���ȱ��ɫ����Һ��Mg2����K����SO42�� ��NO3��
B��ʹ��̪���ɫ����Һ��Na����Cu2����HCO3�� ��NO3��
C��0. 1 mol��L-1AgNO3 ��Һ��H����K����SO42�� ��I��
D��0. 1 mol��L-1NaAlO2 ��Һ H����Na����Cl����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ǰ����(Li2NH)��һ�ִ��������ߡ���ȫ�ԺõĹ��崢����ϣ��䴢��ԭ���ɱ�ʾΪ��Li2NH��H2===LiNH2��LiH�������й�˵����ȷ����(����)
A��Li2NH��N�Ļ��ϼ��ǣ�1
B���÷�Ӧ��H2�������������ǻ�ԭ��
C��Li����H�������Ӱ뾶���
D���˷������ƿ�����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и���Һ�У�һ���ܴ����������
A��Fe3+��Na+��SO42����H2O2 B��C2H5OH��MnO4����H+ ��K+
C��Pb2+��K+ ��SO42����Cl�� D��Na+��SO32�� ��CH3COO-��AIO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA���������ӵ�����������������ȷ����
A����״���£�11.2L��O2��NO�Ļ���ﺬ�еķ�����ԼΪ0.5��6.02��1023
B��1mol���ǻ���1 mol������������������������Ϊ9 NA
C�����³�ѹ��42g ��ϩ�Ͷ�ϩ��������У����Լ���Ϊ6NA
D��6.4g SO2������������Ӧ����SO3��ת�Ƶ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ȼ�ѧ����ʽC(s)��H2O(g) CO(g)��H2(g)����H ��+131.3kJ/mol��ʾ������
CO(g)��H2(g)����H ��+131.3kJ/mol��ʾ������
����A��̼��ˮ��Ӧ����131.3kJ����
����B��1mol̼��1molˮ��Ӧ����һ����̼������������131.3kJ����
����C��1mol��̬̼��1molˮ������Ӧ����һ����̼�����������������131.3kJ
����D��1����̬̼ԭ�Ӻ�1����ˮ������Ӧ����131.1kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1������ר����Ϊ�����ý�������ˮ���е�NO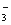 ת��ΪN2���Ӷ������Ⱦ���÷�Ӧ���漰�������У�H2O��Al��OH
ת��ΪN2���Ӷ������Ⱦ���÷�Ӧ���漰�������У�H2O��Al��OH ��Al(OH)3��NO
��Al(OH)3��NO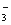 ��N2��д����Ӧ�����ӷ���ʽ ��
��N2��д����Ӧ�����ӷ���ʽ ��
��2���ҹ��״��ĺ������Ժ�ˮΪ�������Һ������ܷ�ӦΪ��4Al+3O2+6H2O=4Al(OH)3����������ĵ缫��ӦʽΪ ��
��3����֪����4Al(s)+3O2(g)=2Al2O3(g) ��H=��2834.9kJ/mol
��Fe2O3(s)+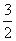 C(s)=
C(s)= 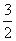 CO2(g)+2Fe(s) ��H=+234.1kJ/mol
CO2(g)+2Fe(s) ��H=+234.1kJ/mol
��C(s)+O2(g)=CO2(g) ��H=��393.5kJ/mol
д�������������������ȷ�Ӧ���Ȼ�ѧ����ʽ ��
��4����һ�������������Ͻ�����ˮ�У��Ͻ�ȫ���ܽ⣬�õ�20mol��pH=14����Һ��Ȼ��2mol/L����ζ����ɵó������������ĵ����������ϵ����ͼ��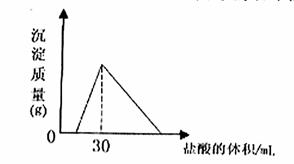 ��Ӧ�����в��������������Ϊ L����״����
��Ӧ�����в��������������Ϊ L����״����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com