
把足量的铁粉投入到溶解有硫酸和硫酸铜的溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为( )。
A.1∶4 B.2∶7 C.1∶2 D.3∶8
科目:高中化学 来源: 题型:
X、Y是同主族的非金属元素,如果X原子半径比Y原子大,则下列说法错误的是( )
A.X的非金属性比Y弱
B.X的原子序数比Y的小
C.x的气态氢化物比Y的气态氢化物稳定
D.x的最高价氧化物对应的水化物的酸性比Y的最高价氧化物对应的水化物的酸性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中生成物总能量高于反应物总能量的是
A.二氧化碳与碳生成一氧化碳 B.镁条在CO2中燃烧生成MgO和C
C.碳酸钙受热分解 D.盐酸与氢氧化钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组
探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
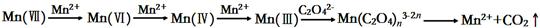 |
【提出假设】假设1: 该反应为放热 假设2:反应生成的Mn2+对该反应有催化作用
假设3: K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是
【设计、完成实验】
(1)称取 g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
① 在上述过程中必须用到的2种定量仪器是托盘天平和 。
② 下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪 色时间 (s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
则x = ,假设 成立
(3)由于KMnO4能氧化水中有机物等因素,配置好稳定的KMnO4溶液,其浓度需标定。
取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,
则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。
上述实验中KMnO4溶液的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分别取W g钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________。
(2)分别取0.1 mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________。
(3)若产生相同物质的量的氢气,所需钠、镁、铝的质量比为________。
(4)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的物质的量比为________。
(5)若将0.2 mol钠、镁、铝分别投入到10 mL 1 mol·L-1的盐酸中,在标准状况下,产生氢气体积的大小顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室将NaClO3和Na2SO3按物质的量之比1∶2倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
I.某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1) 该反应中的还原剂是________。
(2) 该反应中,发生还原反应的过程是________→________。
(3) 写出该反应的化学方程式,并标出电子转移的方向和数目:
_____________________ __ 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
II.高锰酸钾在不同的条件下发生的反应如下:
MnO+5e-+8H+===Mn2++4H2O ①
MnO+3e-+2H2O===MnO2↓+4OH- ②
MnO+e-===MnO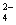 (溶液绿色) ③
(溶液绿色) ③
(1) 从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2) 将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
__________→___________。
(3) 将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________
a. 氧化性:PbO2>KMnO4
b. 还原性:PbO2>KMnO4
c. 该反应可以用盐酸酸化
(4) 将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):
① ________KMnO4+________K2S+______( )===________K2MnO4+________K2SO4+________S↓+______( )。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol•L-1。反应进行2min后A的浓度为0.8 mol•L-1,B的浓度为0.6 mol•L-1,C的浓度为0.6 mol•L-1。则2min内反应的平均速率υ(A)=____________, υ(B)=_________________,υ(C)=_______________。 该反应的化学反应方程式为:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com