
在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中: K+、Al3+、Cl-、SO42-
B.H+浓度为1×10-13mol·L-1的溶液中,Na+、K+、Cl-、NO3-
C.AlO2-浓度为0.1 mol·L-1的溶液中: Na+、K+、HCO3-、Cl-
D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SiO32-
科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)环境专家认为可以用金属铝将水体中的NO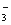 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO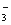 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:①4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
②Fe2O3(s)+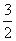 C(s)=
C(s)= 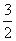 CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图: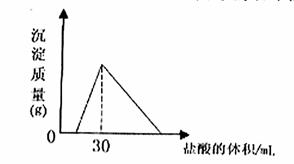 则反应过程中产生氢气的总体积为 L(标准状况)
则反应过程中产生氢气的总体积为 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列装置或操作能达到目的的是
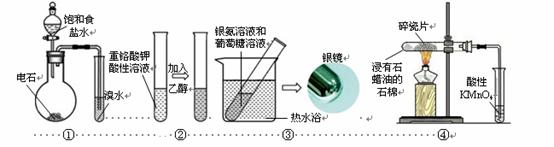
A.装置①:制取乙炔并验证炔烃的性质
B.装置②:检验乙醇的氧化性,溶液颜色从绿色变成橙色
C.装置③:验证葡萄糖分子中含有醛基官能团
D.装置④:酸性KMnO4溶液中出现气泡且颜色逐渐褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质分类或归纳正确的是( )
①电解质:明矾、冰醋酸、氯化银、纯碱 ②同素异形体:金刚石、石墨;C60、C70
③混合物:盐酸、漂白粉、水玻璃、水银 ④化合物:BaCl2、Ca(OH)2、HNO3、HT
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生 素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:

该工艺的主要流程如下:
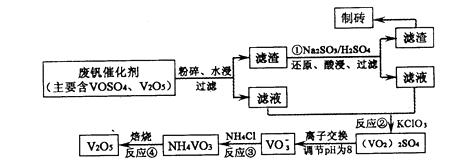
请回答下列问题。
(1)工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式: 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。X为 (写化学式)。
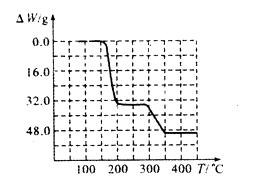
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化 的曲线如上图所示。则NH4VO3在分解过程中 (填序号)。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s,金刚石)=C(s,石墨)△H=-1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g) △H1
C(s,石墨)+O2(g)=CO2(g) △H2
根据已述反应所得出的结论正确的是( )
A、△H1=△H2 B、△H1>△H2 C、△H1<△H2 D、金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度和一定压强的容器中充入4升N2和H2的混合气体,反应达到平衡后,恢复到原温度,体积变为3.4升,容器内气体对相同条件下H2的相对密度为5.
计算:反应达到平衡时V(NH3)= 升,反应前
V(N2):V(H2)= ,N2的转化率为
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法正确的是( )
|
| A. | 用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,燃烧火星四射,放出大量的热,生成红棕色的固体 |
|
| B. | 钠可以与冷水反应生成碱和氢气,铁必须与水蒸气反应才能生成碱和氢气 |
|
| C. | 相同物质的量的钠在常温和加热的条件下与氧气反应所得的产物不同,但转移的电子数相同 |
|
| D. | 等物质的量的铝分别与足量的盐酸和NaOH溶液反应,生成相同条件下氢气的体积比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com