
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。
【答案】CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) ΔH =-48.9 kJ·mol-1 CD K=
CH3OH(g) + H2O(g) ΔH =-48.9 kJ·mol-1 CD K=![]() < 250 d、f 温度 L1>L2 温度一定时,增大压强,CO2平衡转化率增大
< 250 d、f 温度 L1>L2 温度一定时,增大压强,CO2平衡转化率增大
【解析】
(1)根据盖斯定律书写热化学方程式并计算反应热;
(2)达到平衡状态时,正反应速率等于逆反应速率,各物质的浓度、物质的量等不随时间的变化而变化,据此分析判断;
(3)①平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值;
②根据表格中数据的变化关系确定该反应是吸热还是放热;
③根据三段法确定平衡时各物质的浓度,计算出平衡常数,进一步确定反应所处的温度;
(4)要提高CO的转化率,只需让反应平衡正向移动,由此分析判断;
(5)①由图象可知,CO2的转化率逐渐减小,根据温度或压强对平衡移动的影响进行分析;
②X代表温度,L表示压强,该反应为体积缩小的反应,温度一定时,增大压强,平衡正向移动,CO2平衡转化率增大。
(1)①CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
根据盖斯定律可知反应①+反应②可得CO2催化氢化合成甲醇的热化学方程式:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH =-48.9 kJ·mol-1;
H2O(g)+CH3OH(g) ΔH =-48.9 kJ·mol-1;
(2)A. 生成CH3OH的速率与消耗CO的速率相等,不能证明正反应速率等于逆反应速率,因此不能证明反应达到平衡状态,A项错误;
B.该反应中气体的重质量不变,容器为恒容的密闭容器,体积不变,因此混合气体的密度始终不变,因此混合气体的密度不变,不能证明反应达到平衡状态,B项错误;
C. 该反应为气体的物质的量减少的反应,气体的总质量不变,因此当混合气体的相对平均分子质量不变时,反应达到了平衡状态,C项正确;
D. CH3OH、CO、H2的浓度都不再发生变化时,证明反应达到平衡状态,D项正确;
答案选CD;
(3)①根据平衡常数的定义可知,该反应的平衡常数表达式为K=![]() ;
;
②由表格中数据可知,随着温度的升高.平衡常数逐渐减小,因此该反应为放热反应,即△H<0;
③根据已知条件可知:
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
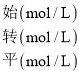
![]()
![]()
![]()
平衡常数K=![]() =
=![]() =2.041,与表格中数据对比可知,该反应的温度为250℃;
=2.041,与表格中数据对比可知,该反应的温度为250℃;
(4)a. 增加CO的浓度,平衡正向移动,但CO的转化率减小,a项错误;
b. 加入催化剂,反应速率加快,但平衡不移动,b项错误;
c. 该反应为放热反应,升高温度,平衡逆向移动,c项错误;
d. 加入H2,平衡正向移动,CO的转化率增大,d项正确;
e. 加入惰性气体,虽增大了压强,但容器的容积不变,各物质的浓度不发生变化,平衡不移动,CO的转化率不变,e项错误;
f. 分离出甲醇,减少了生成物的浓度,平衡正向移动,CO的转化率增大,f项正确;
答案选d、
(5)①由图象可知,CO2的转化率逐渐减小,该反应为放热反应,升高温度,平衡逆向移动,CO2的转化率逐渐减小,因此X代表温度,L表示压强;
②X代表温度,L表示压强,该反应为体积缩小的反应,温度一定时,增大压强,平衡正向移动,CO2平衡转化率增大。因此L1>L2。
化学反应 | mA(g)+nB(g)pC(g)+qD(g) | 是否平衡 |
正、逆反 应速率之 间的关系 | ①单位时间内消耗了m mol A,同时也生成了m mol A | 平衡 |
②单位时间内消耗了n mol B,同时也消耗了p mol C | 平衡 | |
③v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q | 不一定平衡 | |
④单位时间内生成了n mol B,同时也消耗了q mol D | 不一定平衡 | |
混合气体的平均相对分子质量 | ①平均相对分子质量一定,且m+n≠p+q | 平衡 |
②平均相对分子质量一定,且m+n=p+q | 不一定平衡 | |
气体密度(ρ) | ①只有气体参加的反应,密度保持不变(恒容密闭容器中) | 不一定平衡 |
②m+n≠p+q时,密度保持不变(恒压容器中) | 平衡 | |
③m+n=p+q时,密度保持不变(恒压容器中) | 不一定平衡 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学小组在实验室制取漂白粉,并探究氯气与石灰乳反应条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了如图实验装置,进行实验。

请回答下列问题:
(1)①甲装置用于制备氯气,其发生反应的离子方程式为______________乙装置的作用是 _____________
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是___________。(填字母)
A.若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B.若产物为NaClO、NaCl,则吸收后的溶液中c(ClO-)=c(Cl-)
C.若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图(不考虑氯气和水的反应)。则所取石灰乳中含有Ca(OH)2的物质的量为______________mol;

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:

已知:①CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚(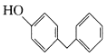 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出下列物质的分子式:含6个碳原子的链状单烯烃__________________________。
(2)在戊烷的各种同分异构体中,一氯代物种类最多的键线式是_________________。
(3)用系统命名法命名 :______________
:______________
(4)某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个-CH3、两个-CH2-、一个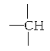 和一个-Cl。它的可能的结构有______________种
和一个-Cl。它的可能的结构有______________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)___________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越__________。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________________(可用分数表示)。
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组学生用如下图所示装置制取丙烯酸甲酯,步骤如下:
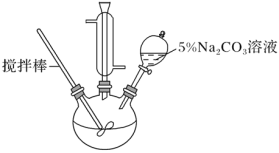
Ⅰ.取10.0 g丙烯酸(CH2=CHCOOH)和6.0 g甲醇、适量的浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
Ⅱ.充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗涤至中性。
Ⅲ.分液,取上层油状液体,加入无水Na2SO4固体,过滤后蒸馏,收集70~90 ℃馏分。
(1) 冷凝管的作用是______
(2) 该实验中可能生成有机副产物的结构简式为____(填一种即可)。
(3) 步骤Ⅱ中混合液用5% Na2CO3溶液洗涤的目的是_______。
(4) 步骤Ⅲ中加入无水Na2SO4固体的作用是______。
(5) 已知甲醇易挥发且有毒性,请写出1条在本实验中需要采取的安全防护措施_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2![]() CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
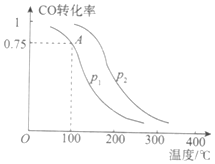
(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________。
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。
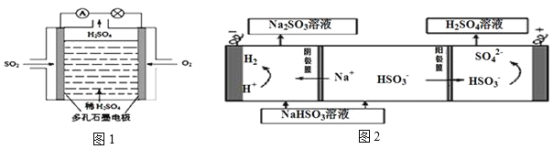
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关含氯物质的说法不正确的是
A.向新制氯水中加入少量碳酸钙粉末能增强溶液的漂白能力
B.向NaClO溶液中通入少量的CO2的离子方程式:CO2+2ClO-+H2O=2HClO+CO32-(已知酸性:H2CO3>HClO>HCO3-)
C.向Na2CO3溶液中通入足量的Cl2的离子方程式:2Cl2+CO32-+H2O=CO2+2Cl-+2HClO
D.室温下,向NaOH溶液中通入Cl2至溶液呈中性时,相关粒子浓度满足:c(Na+)=2c(ClO-)+c(HClO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com