
【题目】某化学小组在实验室制取漂白粉,并探究氯气与石灰乳反应条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了如图实验装置,进行实验。

请回答下列问题:
(1)①甲装置用于制备氯气,其发生反应的离子方程式为______________乙装置的作用是 _____________
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是___________。(填字母)
A.若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B.若产物为NaClO、NaCl,则吸收后的溶液中c(ClO-)=c(Cl-)
C.若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图(不考虑氯气和水的反应)。则所取石灰乳中含有Ca(OH)2的物质的量为______________mol;

【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中混有的氯化氢 AB 0.25
Mn2++Cl2↑+2H2O 除去氯气中混有的氯化氢 AB 0.25
【解析】
(1)①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2,据此写出离子反应方程式;氯气中含有HCl,HCl能和石灰乳生成氯化钙而减少次氯酸钙的产率;
②从浓盐酸和MnO2反应体系中导出的气体中含有氯气和HCl气体;
(2)根据氧化还原反应中得失电子数相等计算n(Cl-),然后根据含氯化合物中钙离子和阴离子的个数比计算氢氧化钙的物质的量;
(1)①制取氯气的离子反应方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;氯气中含有HCl,HCl能和石灰乳生成氯化钙而减少次氯酸钙的产率,HCl极易溶于水,且饱和氯化钠溶液能抑制氯气溶解,所以用饱和氯化钠溶液除去氯气中的HCl,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;氯气中含有HCl,HCl能和石灰乳生成氯化钙而减少次氯酸钙的产率,HCl极易溶于水,且饱和氯化钠溶液能抑制氯气溶解,所以用饱和氯化钠溶液除去氯气中的HCl,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;除去氯气中混有的氯化氢;
Mn2++Cl2↑+2H2O;除去氯气中混有的氯化氢;
②A.根据方程式:3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化剂与还原剂的物质的量之比为5:1;故A错误;
B.导出的气体含氯气、HCl,而氯气与氢氧化钠反应生成等物质的量的次氯酸和盐酸,所以则吸收后的溶液中n(ClO-)<n(Cl-),故B错误;
C.NaOH与Cl2相互反应生成氯化钠、次氯酸钠、氯酸钠,由组成可知钠与氯的物质的量之比为1:1,所以NaOH与Cl2相互反应的物质的量之比一定为2:1,故C正确。
故答案为:AB;
(2)根据氧化还原反应中得失电子数相等计算n(Cl-),设被还原生成的n(Cl-)为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含n(Cl)为:0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol,故答案为:0.25;


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g)达到平衡.下列说法正确的是
CaO(s)+CO2(g)达到平衡.下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2(g), △H<0
C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以辉铜矿为原料生产碱式碳酸铜的工艺流程如图所示:
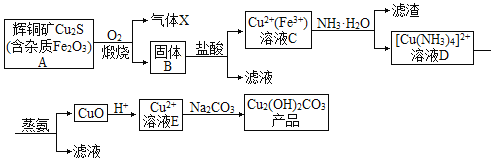
回答下列问题:
(1)若要提高辉铜矿煅烧效率可采取的措施有___(填两种)。
(2)气体X的主要成分是___(填化学式),写出该气体的一种用途___。
(3)蒸氨过程总反应的化学方程式是___。
(4)溶液E与Na2CO3溶液反应制取Cu2(OH)2CO3的离子反应方程式为___。
(5)某实验小组研究溶液E与Na2CO3溶液加料顺序及加料方式对产品的影响,实验结果如下:
实验序号 | 加料顺序及方式 | 沉淀颜色 | 沉淀品质 | 产率/% |
1 | 溶液E一次加入Na2CO3溶液中并迅速搅拌 | 浅蓝色 | 品质较好 | 87.8 |
2 | 溶液E逐滴加入Na2CO3溶液中并不断搅拌 | 暗蓝色 | 品质好 | 71.9 |
3 | Na2CO3溶液一次加入溶液E中并迅速搅拌 | 浅绿色 | 品质好 | 96.7 |
4 | Na2CO3溶液一次加入溶液E中并不断搅拌 | 浅蓝色 | 品质较好 | 102.7 |
由上表可知制取Cu2(OH)2CO3最佳加料顺序及加料方式是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求用合适的化学用语填空
(1)基态P原子的电子排布式:______________
(2)Fe3+ 外围电子排布图:_______________
(3)用电子式表示MgCl2的形成过程:_______
(4)用水解方程式表示明矾能净水的原因:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ),
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ),
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=_____________mol,NO的转化率α1=______________。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2 ,其反应为:2CO+2NO![]() N2+2CO2 ΔH<0
N2+2CO2 ΔH<0
①在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是(________)
A.反应混合物各组分物质的量浓度相等
B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗1molNO的同时,就有1molCO生成
②达到平衡后下列能提高NO转化率的是(________)
A.选用更有效的催化剂B.保持容器体积不变充入氦气增大压强
C.降低反应体系的温度D.缩小容器的体积
③研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | a | b | c | 124 |
Ⅲ | 350 | d | e | 124 |
表中:a=_______________,e=__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质和化合物是人类生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH =+88.6 kJ·mol-1,则M、N相比,较稳定的是__________

(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于_____________ (用△H1 、△H2、△H3表示)
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3)根据键能数据估算CH4(g)+4F2(g)= CF4(g)+4HF(g)的反应热ΔH=________
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化
B.对2HI(g)![]() H2(g)+I2(g)平衡体系增加压强使颜色变深,能用勒夏特勒原理解释
H2(g)+I2(g)平衡体系增加压强使颜色变深,能用勒夏特勒原理解释
C.pH=6的某溶液一定呈酸性
D.二次电池充电时,电池上标有“+”的电极应与外接电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com