
【题目】一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g)达到平衡.下列说法正确的是
CaO(s)+CO2(g)达到平衡.下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2(g), △H<0
C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向移动
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其他条件不变,C的物质的量分数(C)和温度(T)或压强(P)关系如图,其中满足关系图的是( )
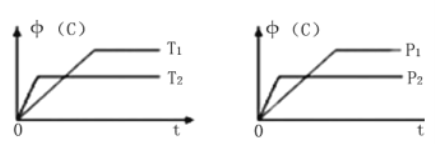
A. 3A(g)+B(s)![]() C(g)+D(g);△H<0
C(g)+D(g);△H<0
B. A(g)+B(s)![]() C(g)+D(g);△H<0
C(g)+D(g);△H<0
C. A(g)+B(s)![]() 2C(g)+D(g);△H>0
2C(g)+D(g);△H>0
D. A(g)+2B(s)![]() C(g)+3D(g);△H>0
C(g)+3D(g);△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多
B.工业生产硫酸,通入过量的空气,提高二氧化硫的转化率
C.久置氯水pH变小
D.高压比常压有利于合成SO3的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 | Ka=6.2×10 |
(1)写出碳酸的第一步电离方程式__________________________________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_____________________ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______________。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN![]() ),下列关系正确的是_______。
),下列关系正确的是_______。
a.c(H+)>c(OH![]() ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH![]() ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN![]() )=0.01mol/L
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10![]() mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10![]() mol/L,则此溶液中由水电离产生的c(H+)=_________。
mol/L,则此溶液中由水电离产生的c(H+)=_________。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10![]() 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L![]() ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式______________________。(Ksp(FeS)=6.3×10![]() ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列说法中正确的是( )
A.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
B.1mol H2SO4与lmol Ba(OH)2完全反应时放出的热叫做中和热
C.已知C(s) + ![]() O2(g) = CO(g) △H=-110.5kJ/mol,则碳的燃烧热为110.5kJ/mol
O2(g) = CO(g) △H=-110.5kJ/mol,则碳的燃烧热为110.5kJ/mol
D.同温同压下,已知两个放热反应:2A(g)+B(g)=2C(1) △H1;2A(l)+B(l)=2C(g) △H2,则△Hl<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对烟道气中![]() 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。
I. ![]() 还原法
还原法

(1)一定条件下,由![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 的能量变化如图所示,每生成
的能量变化如图所示,每生成![]() ,该反应__________(填“放出”或“吸收”)的热量为____________。
,该反应__________(填“放出”或“吸收”)的热量为____________。
(2)在绝热恒容的密闭容器中,进行反应:![]() ,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量![]() ,平衡常数保持不变
,平衡常数保持不变
d.分离出![]() ,正、逆反应速率均保持不变
,正、逆反应速率均保持不变
(3)向![]() 恒温恒容密闭容器中通入
恒温恒容密闭容器中通入![]()
![]() 和
和![]()
![]() ,分别进行
,分别进行![]() 三组实验。在不同条件下发生反应:
三组实验。在不同条件下发生反应:![]() ,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是
,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是![]() ______
______![]() ______
______![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”);实验
”);实验![]() 从反应开始至平衡时,反应速率
从反应开始至平衡时,反应速率![]() ______________。
______________。

II.![]() 溶液吸收法
溶液吸收法
常温下,用![]() 溶液吸收
溶液吸收![]() 的过程中,溶液
的过程中,溶液![]() 随吸收
随吸收![]() 物质的量的变化曲线如图所示。
物质的量的变化曲线如图所示。

(4)常温下,![]() 的二级电离平衡常数
的二级电离平衡常数![]() 的数值为_________________。
的数值为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室制取漂白粉,并探究氯气与石灰乳反应条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了如图实验装置,进行实验。

请回答下列问题:
(1)①甲装置用于制备氯气,其发生反应的离子方程式为______________乙装置的作用是 _____________
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是___________。(填字母)
A.若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B.若产物为NaClO、NaCl,则吸收后的溶液中c(ClO-)=c(Cl-)
C.若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图(不考虑氯气和水的反应)。则所取石灰乳中含有Ca(OH)2的物质的量为______________mol;

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:

已知:①CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚(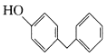 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com