
【题目】下列事实不能用勒夏特列原理解释的是
A.加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多
B.工业生产硫酸,通入过量的空气,提高二氧化硫的转化率
C.久置氯水pH变小
D.高压比常压有利于合成SO3的反应
【答案】A
【解析】
从勒夏特列原理定义的角度分析;
A、MnO2作催化剂,加快H2O2的分解,但化学平衡移动无影响,故A符合题意;
B、二氧化硫与O2反应:2SO2(g)+O2(g) ![]() 2SO3(g),通入过量的空气,增加O2的浓度,平衡向正反应方向移动,SO2的转化率增大,符合勒夏特列原理,故B不符合题意;
2SO3(g),通入过量的空气,增加O2的浓度,平衡向正反应方向移动,SO2的转化率增大,符合勒夏特列原理,故B不符合题意;
C、氯水中存在Cl2+H2O![]() HCl+HClO,HClO在光照条件下:2HClO
HCl+HClO,HClO在光照条件下:2HClO![]() 2HCl+O2↑,促使氯气与水反应,久置氯水的成分是盐酸,符合勒夏特列原理,故C不符合题意;
2HCl+O2↑,促使氯气与水反应,久置氯水的成分是盐酸,符合勒夏特列原理,故C不符合题意;
D、二氧化硫与O2反应:2SO2(g)+O2(g) ![]() 2SO3(g),反应物气体系数之和大于生成物气体系数之和,增大压强,平衡向正反应方向移动,有利于合成SO2,符合勒夏特列原理,故D不符合题意;
2SO3(g),反应物气体系数之和大于生成物气体系数之和,增大压强,平衡向正反应方向移动,有利于合成SO2,符合勒夏特列原理,故D不符合题意;
答案为A。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应或水解方程式不正确的是 ( )
①HCl+H2O![]() H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O![]() H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3—+H2O=CO32—+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
A.①②③④B.①②③C.②③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A.在纯水中加入少量硫酸铵,可抑制水的电离.
B.升高温度,活化分子百分数一定增大,化学反应速率一定增大
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.虽然固体氯化钠不能导电,但氯化钠是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③13.6g硫化氢,④0.2mol氨气(NH3)。下列对这四种气体的关系从大到小描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>①>④D.氢原子数①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0
(1)图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程![]() 曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
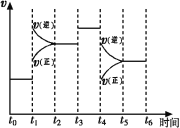
t4时改变的条件是________________。
现进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)反应在0—10分钟内以氮气浓度变化表示的反应速率为___________,该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L/span>,则此时V正_____V逆 (填“>”“<”或“=”)。
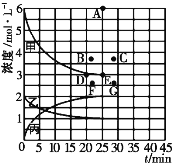
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______(填“甲”“乙”或“丙”)。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g)达到平衡.下列说法正确的是
CaO(s)+CO2(g)达到平衡.下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2(g), △H<0
C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以辉铜矿为原料生产碱式碳酸铜的工艺流程如图所示:
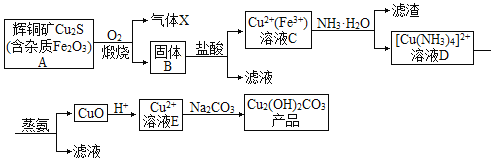
回答下列问题:
(1)若要提高辉铜矿煅烧效率可采取的措施有___(填两种)。
(2)气体X的主要成分是___(填化学式),写出该气体的一种用途___。
(3)蒸氨过程总反应的化学方程式是___。
(4)溶液E与Na2CO3溶液反应制取Cu2(OH)2CO3的离子反应方程式为___。
(5)某实验小组研究溶液E与Na2CO3溶液加料顺序及加料方式对产品的影响,实验结果如下:
实验序号 | 加料顺序及方式 | 沉淀颜色 | 沉淀品质 | 产率/% |
1 | 溶液E一次加入Na2CO3溶液中并迅速搅拌 | 浅蓝色 | 品质较好 | 87.8 |
2 | 溶液E逐滴加入Na2CO3溶液中并不断搅拌 | 暗蓝色 | 品质好 | 71.9 |
3 | Na2CO3溶液一次加入溶液E中并迅速搅拌 | 浅绿色 | 品质好 | 96.7 |
4 | Na2CO3溶液一次加入溶液E中并不断搅拌 | 浅蓝色 | 品质较好 | 102.7 |
由上表可知制取Cu2(OH)2CO3最佳加料顺序及加料方式是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.明矾水解形成的Al(OH)3胶体能杀菌消毒,可用于水的净化
B.对2HI(g)![]() H2(g)+I2(g)平衡体系增加压强使颜色变深,能用勒夏特勒原理解释
H2(g)+I2(g)平衡体系增加压强使颜色变深,能用勒夏特勒原理解释
C.pH=6的某溶液一定呈酸性
D.二次电池充电时,电池上标有“+”的电极应与外接电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com