
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0
(1)图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程![]() 曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
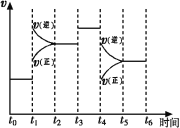
t4时改变的条件是________________。
现进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)反应在0—10分钟内以氮气浓度变化表示的反应速率为___________,该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L/span>,则此时V正_____V逆 (填“>”“<”或“=”)。
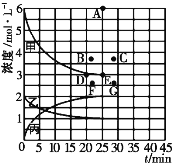
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______(填“甲”“乙”或“丙”)。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。
【答案】D 减小压强或增大容积体积 0.08mol/(L·min) ![]() (或0. 148或0. 15均可) > 乙 B
(或0. 148或0. 15均可) > 乙 B
【解析】
(1)从化学平衡移动的角度进行分析;
(2)根据化学速率的表达式进行计算;利用三段式计算化学平衡;
(3)利用Qc与K之间的关系进行分析;
(4)利用影响化学速率的因素以及影响化学平衡移动的因素进行分析。
(1)根据图像,t1-t2时间反应向逆反应方向进行,消耗NH3,t3-t4时间段,化学平衡不移动,t4-t5时间段,反应向逆反应方向进行,消耗NH3,因此氨气的体积分数最小的时间段是t5-t6,故选项D正确;t4时刻,正逆反应速率都降低,可能降低温度,也可能减小压强,如果是降低温度,该反应为放热反应,平衡影响正反应方向进行,v正>v逆,不符合图像,因此只能是减小压强,
故答案为D;减小压强或增大容器的体积;
(2)0-10min消耗H2的物质的量为(6.00-3.60)mol=2.40mol,根据反应方程式,消耗N2的物质的量为![]() =0.8mol,依据反应速率的数学表达式,v(N2)=
=0.8mol,依据反应速率的数学表达式,v(N2)=  =0.08mol/(L·min);
=0.08mol/(L·min); 容器的体积为1L,则N2、H2、NH3的平衡浓度分别是1mol·L-1、3mol·L-1、2mol·L-1,根据化学平衡常数的表达式,K=
容器的体积为1L,则N2、H2、NH3的平衡浓度分别是1mol·L-1、3mol·L-1、2mol·L-1,根据化学平衡常数的表达式,K=![]() ,
,
故答案为0.08mol/(L·min);![]() (或0. 148或0. 15均可);
(或0. 148或0. 15均可);
(3)利用Qc=![]() <
<![]() 平衡向正反应方向进行,即v(正)>v(逆),
平衡向正反应方向进行,即v(正)>v(逆),
故答案为>;
(4)开始通入N2、H2物质的量浓度分别是2mol·L-1、6mol·L-1,根据图像,起点为2mol·L-1的点为乙曲线,则乙曲线表示c(N2)-t的曲线;根据上述分析,曲线甲表示c(H2)-t,在此温度下,起始充入4molN2和12molH2,相当于在原来基础上增大压强,化学反应速率加快,达到平衡所用时间缩短,相当于在原来基础上增大压强,该反应的平衡向正反应方向进行,即比原平衡的2倍小,则应是B点,
故答案为乙;B。


科目:高中化学 来源: 题型:
【题目】下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是

A. 充电时,a为电源正极
B. 充电时,Cl-向Bi电极移动,Na+向NaTi2(PO4)2电极移动
C. 充电时,新增入电极中的物质:n(Na+):n(Cl-)=1:3
D. 放电时,正极的电极反应为BiOCl+2H++3e-=Bi+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100 mL。莫尔法是较简单的一种测量Cl-含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):
Ag++Cl-=AgCl↓(白色) Ksp(AgCl)=1.8×10-23
2Ag++CrO42-=Ag2CrO4↓(砖红) Ksp(Ag2CrO4)=1.2×10-22
准确移取酱油样品5.00 mL稀释至100 mL。从其中取出10.00 mL 置于锥形瓶中,再向其中加入适量的K2CrO4溶液,以0.100 0 mol/L的硝酸银标准溶液滴定,重复实验三次。
(1)样品稀释过程中,用_____移取酱油样品,应在______中定容,还需用到玻璃仪器_______________。
(2)滴定中眼睛应注视____________,出现_____________即达到滴定终点。
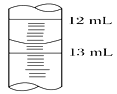
(3)滴定结束时,滴定管中液面如右图所示,则读数为________。
(4)若三次消耗硝酸银标准溶液的平均体积为12.50 mL,则稀释后的酱油中NaCl的浓度为________mol/L,该市售酱油是否符合NaCl含量标准 ________(填“符合”或“不符合”)。
(5)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),此离子沉淀完全(离子浓度≤10-5)时溶液的pH为________________已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=1.0×10-21。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
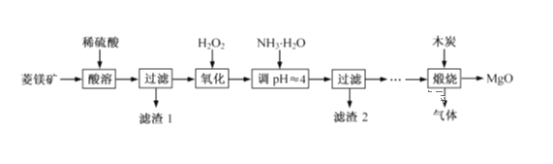
(1)MgCO3与稀硫酸反应的离子方程式为__________________________。
(2)加入H2O2氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式),过滤分离需要的玻璃仪器有 __________________。
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑
MgSO4+3C=MgO+S↑+3CO↑
利用图装置对煅烧产生的气体进行分步吸收或收集。
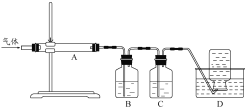
D中通过排水法收集的气体可以是___________(填化学式)。C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
(5)A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多
B.工业生产硫酸,通入过量的空气,提高二氧化硫的转化率
C.久置氯水pH变小
D.高压比常压有利于合成SO3的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_____________;在酸性很弱或中性条件下,其发生___________________ (填“析氢腐蚀”或“吸氧腐蚀”)。
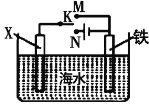
(2)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,开关K置于N处,该电化学防护法称为____________________;若X为锌棒,开关K置于M处,________(填“能”或“不能”)达到防止铁腐蚀![]() 目的。
目的。
II.如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:

(1)甲池燃料电池的负极反应为___________________。
(2)乙池中石墨电极为___________极,发生_____________反应(填“氧化”或“还原”)写出乙池中电解总反应的化学方程式: ___________________。
(3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生________g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列说法中正确的是( )
A.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
B.1mol H2SO4与lmol Ba(OH)2完全反应时放出的热叫做中和热
C.已知C(s) + ![]() O2(g) = CO(g) △H=-110.5kJ/mol,则碳的燃烧热为110.5kJ/mol
O2(g) = CO(g) △H=-110.5kJ/mol,则碳的燃烧热为110.5kJ/mol
D.同温同压下,已知两个放热反应:2A(g)+B(g)=2C(1) △H1;2A(l)+B(l)=2C(g) △H2,则△Hl<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。

请回答下列问题:
(1)步骤I中除了2Li + 2H2O=2 Li OH + H2↑反应外,主要发生的化学反应方程式为____________________。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是

A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com