
| A、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、0.1 mol?L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1 mol?L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.01 mol?L-1 NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |


科目:高中化学 来源: 题型:
| A、在c(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- |
| B、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| C、在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
| D、pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚钠溶液中通入CO2气体后产生白色沉淀,通过抽滤可分离出苯酚 |
| B、滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液 |
| C、基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其的反应速率 |
| D、某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1 |
| B、浓度均为0.1 mol?L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) |
| C、25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D、3.0L 0.1mol?L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+?AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液.下列叙述中正确的是( )
如图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+?AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液.下列叙述中正确的是( )| A、甲组操作时,电流计(G)指针发生偏转 |
| B、甲组操作时,溶液颜色变浅 |
| C、乙组操作时,C2做正极 |
| D、乙组操作时,C1上发生的电极反应为I2+2e-═2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢氟酸在玻璃上“刻字”:SiO2+4H++4F-═SiF4↑+2H2O |
| B、实验室制取氯气:2MnO4-+8H++6Cl-═2MnO2↓+3Cl2↑+4H2O |
| C、将铁粉放入硫酸铁和硫酸铜的混合溶液中,初始阶段发生的反应:Fe+2Fe3+═3Fe2+ |
| D、常温下,铁与过量的浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入少量的CH3COONa |
| B、向水中加入少量的NaHSO4 |
| C、向水中加入NaI并加热至100℃,pH=6 |
| D、向水中加少量的KAl(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
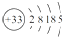 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
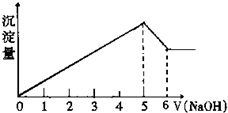 有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( )
有一镁、铝合金,在适量稀硫酸中恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠溶液的体积变化如图所示,则合金中镁、铝的物质的量之比为( )| A、2:1 | B、4:1 |
| C、1:1 | D、1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com