
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
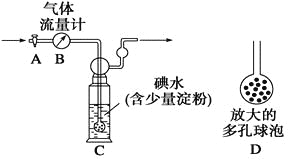
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
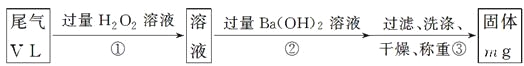
(3)步骤①中过量H2O2的作用是________________________________________
(4)写出步骤②中反应的化学方程式_______________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是________________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为__________________________(用含有V、m的代数式表示)。
【答案】增大气体与溶液的接触面积,有利于SO2与碘水反应 偏低 使SO2完全转化为SO42- H2SO4+Ba(OH)2=BaSO4↓+2H2O 静置分层后,往上层溶液中继续滴加Ba(OH)2溶液,若无浑浊现象产生,则Ba(OH)2已足量,反之不足 ![]() 或
或![]() ×100%
×100%
【解析】
甲方案利用的原理为:I2+SO2+2H2O=H2SO4+2HI,最后测定剩余气体的体积,进而定尾气中二氧化硫的含量。
乙方案利用的原理为:SO2+H2O2 =H2SO4,Ba (OH)2+ H2SO4=BaSO4↓+ 2H2O,最后沉淀硫酸钡的质量计算尾气中二氧化硫的质量,进而计算尾气二氧化硫含量。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低;
(3)由方案原理可知,H2O2是将SO2完全转化为SO42-;
(4)步骤②中反应的化学方程式为: Ba (OH)2+ H2SO4=BaSO4↓+ 2H2O;
(5)步骤②中Ba (OH)2是否足量的判断方法是:静置分层后,向上层清液中继续滴加Ba (OH)2溶液,若无浑浊现象产生说明Ba (OH)2足量,否则不足;
(6)mg是硫酸钡的质量,硫酸钡的物质的量为n(BaSO4)= ![]() mol,根据硫元素守恒可知二氧化硫的体积为V(SO2)=
mol,根据硫元素守恒可知二氧化硫的体积为V(SO2)= ![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L,故尾气中二氧化硫的体积分数是
L,故尾气中二氧化硫的体积分数是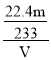 =
=![]() 。
。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中,X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半;U的最高化合价和最低化合价的代数和为6;R和Q可形成原子个数之比为1:1和2:1的两种化合物;T与Z同主族。请回答下列问题:
(1)T元素在周期表中的位置是________________________。
(2)X、Z、Q三种元素的原子半径由小到大的顺序为___________(填元素符号)。
(3)R、T两元素最高价氧化物对应的水化物反应的化学方程式为____________。
(4)某同学用X、R两元素的单质反应生成固体物质RX,RX属于离子化合物,且能与化合物X2Q反应生成X的单质。
①RX的电子式为_____________;RX与X2Q反应的化学方程式为___________。
②该同学认为取X、R两元素的单质反应后的固体物质与X2Q反应,若能产生![]() 的单质,即可证明得到的固体物质一定是纯净的RX。请判断该方法是否合理并说明理由:_____________。
的单质,即可证明得到的固体物质一定是纯净的RX。请判断该方法是否合理并说明理由:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为_______________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_______________________。
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为___________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为___________,
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子。
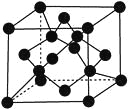
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(A1N)是一种新型无机非金属材料。某A1N样品仅含有Al2O3杂质,为测定A1N的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案一)
取一定量的样品,用以下装置测定样品中A1N的纯度(夹持装置已略去)。
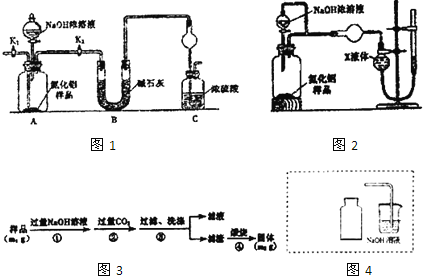
(1)如图1C装置中球形干燥管的作用是___。
(2)完成以下实验步骤:组装好实验装置,首先___再加入实验药品。接下来的实验操作是___,打开分液漏斗活塞,加入浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化,通入氮气的目的是___。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见____。
(方案二)
用如图2装置测定mg样品中A1N的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是___。
a.CCl4 b.H2O c.NH4Cl溶液 d.苯
(5)若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数____。
(方案三)
按如图3步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为____。
(7)若在步骤③中未洗涤,测定结果将___(填“偏高”“偏低’或“无影响”)。
(8)实验室制取NO2气体。在如图4虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图___(夹持仪器略)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO![]() +4H+
+4H+
CuCl43﹣(aq)CuCl(s)+3Cl﹣(aq)

①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物![]()
![]()
![]()
![]()
![]() CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)ClH2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种短周期非金属元素的原子半径与原子序数有如图所示的关系,化合物
五种短周期非金属元素的原子半径与原子序数有如图所示的关系,化合物![]() 是水煤气的主要成分之一,下列说法不正确的是
是水煤气的主要成分之一,下列说法不正确的是
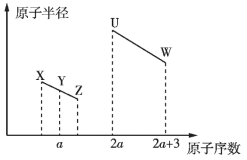
A.![]() 与氢氧化钠溶液反应可能生成酸式盐
与氢氧化钠溶液反应可能生成酸式盐
B.![]() 与
与![]() 形成的化合物中含有离子键
形成的化合物中含有离子键
C.![]() 、
、![]() 、
、![]() 元素的最高价氧化物对应水化物的酸性依次增强
元素的最高价氧化物对应水化物的酸性依次增强
D.若元素![]() 的原子序数大于
的原子序数大于![]() 且与
且与![]() 同主族,则
同主族,则![]() 的金属性强于
的金属性强于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是

A.增大压强,①→②之间的能量差值会增大
B.合成氨的正逆反应的焓变相同
C.合成氨的过程是吸热反应
D.若使用催化剂,生成等量的NH3需要的时间更短
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.pH=8的CH3COONa溶液:c(CH3COOH)=9.9×10-7 mol·L-1
B.0.1 mol·L-1Na2SO3溶液:c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.0.1 mol·L-1NaHCO3溶液:c(Na+)+c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
D.0.1 mol·L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com