
����Ŀ��X��Z��Q��R��T��U�ֱ����ԭ��������������Ķ�����Ԫ�أ������ڱ��Ķ���������Ԫ���У�X��ԭ�Ӱ뾶��С��X��R��������������ȣ�Z���ڲ��������������������һ�룻U������ϼۺ���ͻ��ϼ۵Ĵ�����Ϊ6��R��Q���γ�ԭ�Ӹ���֮��Ϊ1��1��2��1�����ֻ����T��Zͬ���塣��ش��������⣺
(1)TԪ�������ڱ��е�λ����________________________��
(2)X��Z��Q����Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ___________����Ԫ�ط��ţ���
(3)R��T��Ԫ������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽΪ____________��
(4)ijͬѧ��X��R��Ԫ�صĵ��ʷ�Ӧ���ɹ�������RX��RX�������ӻ���������뻯����X2Q��Ӧ����X�ĵ��ʡ�
��RX�ĵ���ʽΪ_____________��RX��X2Q��Ӧ�Ļ�ѧ����ʽΪ___________��
�ڸ�ͬѧ��ΪȡX��R��Ԫ�صĵ��ʷ�Ӧ��Ĺ���������X2Q��Ӧ�����ܲ���![]() �ĵ��ʣ�����֤���õ��Ĺ�������һ���Ǵ�����RX�����жϸ÷����Ƿ������˵�����ɣ�_____________��
�ĵ��ʣ�����֤���õ��Ĺ�������һ���Ǵ�����RX�����жϸ÷����Ƿ������˵�����ɣ�_____________��
���𰸡��������ڢ�A�� H<O<C 2NaOH+H2SiO3=Na2SiO3+2H2O ![]() NaH+H2O=NaOH+H2�� ������������Ӧ����Na������Ҳ����ˮ��Ӧ����H2
NaH+H2O=NaOH+H2�� ������������Ӧ����Na������Ҳ����ˮ��Ӧ����H2
��������
X��Z��Q��R��T��U�ֱ����ԭ��������������Ķ�����Ԫ�أ����ڱ���ȫ��Ԫ����X��ԭ�Ӱ뾶��С����XΪHԪ�أ�X��R��������������ȣ�����ԭ������������2����RΪNaԪ�أ���֪Z��Q���ڵڶ����ڣ�Z���ڲ��������������������һ�룬Z�ĺ�������Ų�Ϊ2��4��Zԭ������������Ϊ4����ZΪCԪ�أ�U������ϼۺ���ͻ�����Ĵ�����Ϊ6����UΪClԪ�أ�R��Q����ԭ����֮��Ϊ1��1��2��1�����ֻ������QΪOԪ�أ������ֻ�����ΪNa2O2��Na2O��T��Zͬ���壬����Z��CԪ�أ�����TΪSiԪ�أ��ݴ˷������
��������������֪��XΪH��ZΪC��QΪO��RΪNa��TΪSi��UΪClԪ�ء�(1)TΪSiԪ�أ�ԭ�Ӻ�������Ų�Ϊ2��8��4������SiԪ�����ڱ��е�λ���ǵ�������IVA�壻
(2) XΪH��ZΪC��QΪO��ͬһ����Ԫ��ԭ������Խ��ԭ�Ӱ뾶ԽС��ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ��������������Ԫ����ԭ�Ӱ뾶��С����˳��ΪH<O<C��
(3) RΪNa��TΪSi�����ǵ�����������Ӧ��ˮ����ֱ�ΪNaOH��H2SiO3��H2SiO3�����ᣬ������ǿ��NaOH�����кͷ�Ӧ����Na2SiO3��H2O����Ӧ�Ļ�ѧ����ʽΪ��2NaOH+H2SiO3=Na2SiO3+2H2O��
(4) XΪH��RΪNa��QΪO��H��Na����Ԫ���γɵĻ�����NaH�����ӻ����X2Q��H2O��NaH��H2O��Ӧ����NaOH�� H2��
��NaH��Na+��H-ͨ�����Ӽ���ϣ�����ʽΪ![]() ��NaH��H2O��Ӧ����NaOH�� H2����Ӧ����ʽΪ��NaH+H2O=NaOH+H2����
��NaH��H2O��Ӧ����NaOH�� H2����Ӧ����ʽΪ��NaH+H2O=NaOH+H2����
������Na�Ƿdz����õĽ�����������ˮ��Ӧ����H2����Ӧ����ʽΪ2Na+2H2O=2NaOH+H2�������������Na������������Na��ˮ��ӦҲ������������˲��ܸ���H��Na��Ӧ��Ĺ�����ˮ��Ӧ�ų�����ȷ���õ��Ĺ���һ���Ǵ���NaH������ͬѧ��˵����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����(��FeO��Cr2O3��Al2O3��SiO2��)Ϊԭ���Ʊ���������ص�ʵ�鲽������:
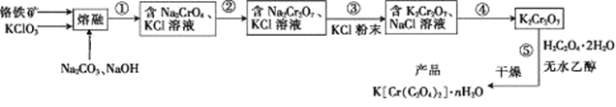
�ش��������⣺
��1���������ڡ��������н��У�����ʿ�����____(����������մɡ���SiO2��)��
��2�� FeO��Cr2O3��KClO3��Na2CO3������Ӧ������Fe2O3��KCl��Na2CrO4��CO2�Ļ�ѧ����ʽΪ____________________________��
��3�����ں�Ĺ����к�Na2CrO4��Fe2O3��Na2SiO3��NaAlO2��KCl��, ����ٰ������ι��˲�����һ��ˮ������ˣ����ǵ���������ҺpHΪ7~8��������а�Сʱ�����ȹ��ˡ���һ�ι��������е���Ҫ�ɷ�Ϊ______���ڶ��ι�����������Ҫ�ɷ�Ϊ_________��
��4�������������ᣬ�����ϡ����ʱ������Ӧ�����ӷ���ʽΪ___________��
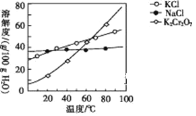
��5������ܰ����ľ��������_____��_____�����ˡ�ϴ�ӣ��پ�����õ�K2Cr2O7���塣(�й����ʵ��ܽ��������ͼ��ʾ)
��6����֪K[Cr(C2O4)2]����Է�������Ϊ267���������ط������ⶨK[Cr(C2O4)2]��nH2O��Ʒ�����ᾧˮ��Ŀ������Ʒ���ȵ�80 ��ʱ��ʧ��ȫ���ᾧˮ��ʧ��16.8%��K[Cr(C2O4)2]��nH2O������n=____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2018��3���Ͼ����������Ƴ���һ���µ�ȫ������������AgN5��Ŀǰ�Ѿ��ϳɳ��ơ��̡������ܡ�����þ�ȼ��ֽ�����ȫ���������Ρ�
(1)��̬Mn2+�ļ۵����Ų�ʽΪ____������ͭλ��ͬһ�壬��Ԫ��λ��Ԫ�����ڱ���___����
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-�ľ���IJ��ֽṹ��ͼ1��ʾ��
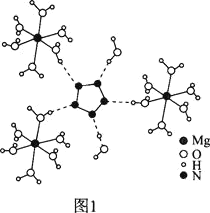
N��O��MgԪ�ص�ǰ3�����������±���ʾ��
Ԫ�� | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
��X��Y��Z��ΪNԪ�ص���____���ж�������__________��
�ڴ����������Ϳ���Mg2+��H2O֮����________��N5��H2O֮����________��
��N5-Ϊƽ��������Σ�Nԭ�ӵ��ӻ�������_______����ѧ��Ԥ�⽫�������Ƴ���N4-��N6-��ƽ�滷״�ṹ���ӵ��Σ���һ�������ж����ڴ����������÷���![]() ��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ
��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ![]() )����N4-�еĴ�����Ӧ��ʾΪ_________��
)����N4-�еĴ�����Ӧ��ʾΪ_________��
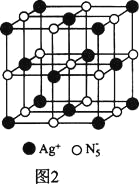
(3)AgN5�����������ṹ��ͼ2��ʾ��Ag+��Χ���������Ag+��_______�����������н��ڵ�N5-��Ag+��ƽ������Ϊa nm��NA��ʾ�����ӵ�������ֵ����AgN5���ܶȿɱ�ʾΪ_____gcm-3���ú�a��NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ճ������У����Ǿ�����������Ʒ���⡢����Ʒ������ְװߵ��ڶ�Ľ�����ʴ������ͨ������װ����ʾʵ�����̽��������˵����ȷ���� ( )

A. ��ͼ��װ��ʵ�飬Ϊ�˸���������ع۲쵽Һ���������ɲ������з������þƾ��Ƽ��Ⱦ�֧�Թ�
B. ͼ����ͼ����ʾװ�õ�ԭ��ʾ��ͼ��ͼ���������������
C. ����Ʒ������ְװ߿���ͨ��ͼ��װ�ý���̽����Cl���ɻ���̿��������������Ǩ�ƣ��������缫��Ӧ��2Cl����2e��=Cl2��
D. ͼ��װ�õ��ܷ�ӦΪ4Al��3O2��6H2O=4Al(OH)3�����ɵ�Al(OH)3��һ����ˮ�γɰװ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���H+��Na+��NH4+��Fe3+��Al3+��SO42-�����ӡ������Һ�еμ�NaOH��Һ�����ɳ��������ʵ����仯������ͼ��ʾ�������й��ж���ȷ���� �� ��
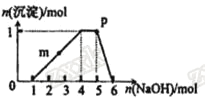
A.m�㴦��Ӧ��H++OH-=H2O
B.p�㣺c(OH-)��c(NH4+)>c(H+)
C.��ȡԭ��Һ����ɫ��Ӧʵ�飬��ɫӦΪ��ɫ
D.ԭ��Һ�д��ڵ���Ҫ���ӣ�n(H+)=2n(NH4+)=n(Al3+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA(g)��bB(g)![]() cC(g)��dD(s)��H��QkJ��mol��1����Ӧ�����У���������������ʱ����ѧƽ�ⳣ��(K)���¶ȣ�C�İٷֺ�����ʱ��Ĺ�ϵ��ͼ��ʾ����ͼ����������˵���������
cC(g)��dD(s)��H��QkJ��mol��1����Ӧ�����У���������������ʱ����ѧƽ�ⳣ��(K)���¶ȣ�C�İٷֺ�����ʱ��Ĺ�ϵ��ͼ��ʾ����ͼ����������˵���������
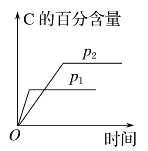
A.Q��0
B.����ѹǿ��B��ת��������
C.����Ӧ��ƽ��ʱ�����������ܶȲ��ٱ仯
D.p1��p2��a��b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ����һ���ڱ��е�λ�ã��û�ѧ����ش��������⣺
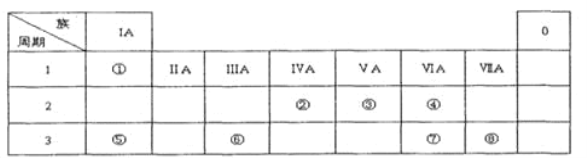
������1���뻭��Ԫ�����������ӽṹʾ��ͼ_________��
��2��������������ԭ�Ӱ뾶��С�����˳��Ϊ________��
��3��������������������Ӧˮ����ļ���ǿ��Ϊ_______>______��
��4������������Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ĵ���ʽΪ__________��
�����ɱ�����һ���е�һ�ֻ���Ԫ���γɵij�������A��B��C�ɷ������·�Ӧ������������ȥ�����Իش�
![]()
��1����X��һ�ֳ������ɽ������ʣ���C��ˮ��Һ�еμ�AgNO3��Һ������������ϡHNO3�İ�ɫ������C��Һ�н�������������������Һ��Ӧ�IJ����ڿ����з�����ɫ�仯�ķ���ʽ________����֪��������Һ�иý��������ܱ�˫��ˮ������д���÷�Ӧ�����ӷ���ʽ_________________��
��2����A��B��CΪ����ͬһ����Ԫ�ص��������XΪǿ����ʣ�A��Һ��C��Һ��Ӧ����B����B�Ļ�ѧʽΪ______��д��A��C����Һ��Ӧ�����ӷ���ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L��1 NaOH��Һ�ζ�40 mL 0.1 mol��L��1 H2SO3��Һ�����õζ�������ͼ��ʾ�����Ի��ʱ��Һ����ı仯������������������ǣ� ��
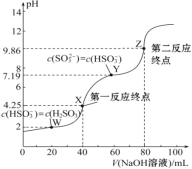
A. Ka2(H2SO3)��������Ϊ10��8
B. ���ζ�����һ��Ӧ�յ㣬���ü�����ָʾ��
C. ͼ��Z���Ӧ����Һ�У�c(Na��)>c(SO32��)>c(HSO3��)>c(OH��)
D. ͼ��Y���Ӧ����Һ�У�3c(SO32��)��c(Na��)��c(H��)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ṥҵβ���ж�������ĺ�������0.05%(�������)ʱ�辭����������ŷš�ijУ��ѧ��ȤС�����ⶨij���Ṥ���ŷ�β���ж�������ĺ������ֱ�������·�����
[����]����ͼ��ʾ��ͼ������������B����ȷ����ͨ����β���������β��ͨ��һ�������֪Ũ�ȵĵ�ˮ�вⶨSO2�ĺ�������ϴ��ƿC����Һ��ɫ��ʧʱ�������رջ���A��
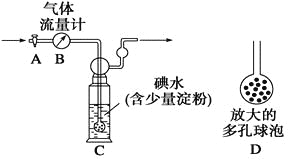
(1)ϴ��ƿC�е���ĩ������һ���������D���������ʵ���ȷ�ȣ���������_______________________________________��
(2)ϴ��ƿC����Һ��ɫ��ʧ��û�м�ʱ�رջ���A����õ�SO2����____________(����ƫ��������ƫ����������Ӱ����)��
[�ҷ���]��ʵ�鲽������������ͼ��ʾ��
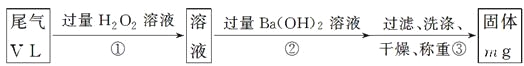
(3)��������H2O2��������________________________________________
(4)д��������з�Ӧ�Ļ�ѧ����ʽ_______________________________________
(5)�������Ba(OH)2�Ƿ��������жϷ�����________________________________
(6)ͨ����β�����ΪVL(�ѻ���ɱ�״��)ʱ����β���ж�������ĺ���(�������)Ϊ__________________________(�ú���V��m�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com