
【题目】写出除去下列物质中杂质所选用的试剂及发生反应的离子方程式:
(1)盐酸(硫酸),试剂_________,离子方程式__________________________;
(2)NaOH(Na2CO3),试剂________,离子方程式___________ _________ ___;
(3)NaCl(CuCl2),试剂________,离子方程式_______________________ __。
【答案】(1)适量BaCl2溶液 Ba2++SO![]() ===BaSO4↓
===BaSO4↓
(2)适量Ba(OH)2溶液或氢氧化钙 Ba2++CO![]() ===BaCO3↓
===BaCO3↓
(3)适量NaOH溶液 Cu2++2OH-===Cu(OH)2↓
【解析】
试题分析:(1)盐酸(硫酸),杂质离子为硫酸根离子,可以加入适量的氯化钡溶液除去杂质硫酸根离子,反应的离子方程式为:Ba2++SO42-═BaSO4↓;
(2)NaOH(Na2CO3),杂质离子为碳酸根离子,可以加入适量的氢氧化钡溶液,反应生成了碳酸钡沉淀和氢氧化钠,反应的离子方程式为:Ba2++CO32-═BaCO3↓;
(3)NaCl(CuCl2),杂质离子为铜离子,可以加入适量的氢氧化钠溶液,使铜离子生成氢氧化铜沉淀除去,反应的离子方程式为:Cu2++2OH-═Cu(OH)2↓。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+2B(g)![]() 2C(g)达到平衡状态标志的是
2C(g)达到平衡状态标志的是
①C的生成速率与C的分解速率相等;
②单位时间生成amol A,同时生成3amolB;
③A、B、C的浓度不再变化;
④混合气体平均摩尔质量不再变化
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦单位时间内消耗amol A,同时生成3amol B ⑧A、B、C的分子数比为1:3:2
A.②⑧ B.①⑥ C.②④ D.③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) ![]() 2CO2(g)+S(l) ΔH<0,
2CO2(g)+S(l) ΔH<0,
若反应在恒容的密闭容器中进行,下列有关说法正确的是
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌粒和盐酸反应一段时间后,反应速率减慢。此时加热或加入浓盐酸,反应速率明显加快。上述实验中影响化学反应速率的因素有
①温度 ②固体的表面积 ③反应物的状态 ④溶液的浓度 ⑤催化剂
A.①④ B.①③ C.②④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42﹣ HCO3﹣ NO3﹣ OH﹣ |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
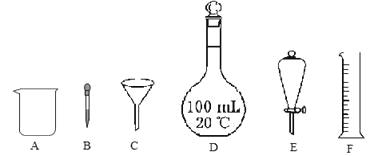
(1)下列各组混合物中,能用仪器E进行分离的是 (填序号)。
a.水和四氯化碳 b.水和酒精 c.水中的泥沙
(2)配制100mL 0.1 mol·L-1NaOH溶液,所需氢氧化钠固体的质量是 g。实验中用到的上述仪器有 (填序号),还缺少的玻璃仪器是 (填仪器名称)。
Ⅱ、现有下列四种物质,①H2 ②Cl2 ③SO2 ④H2SO4
请回答相关问题:

(1)如右图所示,从B口进气可收集的气体是 (填序号,下同)。
(2)能使品红溶液褪色且加热时又复原的是 ;属于电解质的是 ;能与水发生氧化还原反应的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案.(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)

(1)操作a的名称为 ,所需要的玻璃仪器为 。
(2)固体E的成分为 ,加入的试剂④为稀硫酸,发生的化学方程式为 。
(3)加入试剂①的目的是 。
(4)从溶液D和溶液G中得到FeSO47H2O晶体的操作为 、冷却结晶、过滤、 、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com