
合成氨工厂常通过测定反应前后混合气体的密度来确定氮的转化率.某工厂测得合成塔中N2、H2混合气体的密度为0.379g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L.求该合成氨厂N2的转化率.(写出计算过程)
| 化学方程式的有关计算.. | |
| 专题: | 计算题. |
| 分析: | 先根据M=ρVm计算混合气体的平均摩尔质量,计算反应前混合气体中N2和H2的物质的量之比,假设氮气、氢气的起始物质的量,设转化的氮气为ymol,表示出反应结束后各组分的物质的量,再根据平均摩尔质量列方程计算,进而计算氮气的转化率. |
| 解答: | 解:设反应前混合气体中氮气的物质的量分数为x,氢气物质的量分数为(1﹣x),依题意得: 28x+2(1﹣x)=0.379×22.4 解得x=0.25 所以N2、H2的物质的量之比为0.25:(1﹣0.25)=1:3, 设起始N2的物质的量为1mol,H2为3 mol,N2的转化量为y mol,则: N2 +3 H2 ⇌2 NH3 开始(mol):1 3 0 变化(mol):y 3y 2y 结束(mol):1﹣y 3﹣3y 2y 总物质的量=(1﹣y+3﹣3y+2y)mol=(4﹣2y)mol =0.693×22.4 解得 y=0.905 所以N2的转化率为×100%=90.5%, 答:该合成氨厂N2的转化率为90.5%. |
| 点评: | 本题考查混合物计算、化学方程式计算,注意利用三段式解答,难度不大. |


科目:高中化学 来源: 题型:
下列说法正确的是
A、水是一种非常稳定的化合物,这是由于氢键所致
B、乙醇分子中有一个手性碳原子
C、离子晶体的晶格能越大离子键越强
D、电负性Na﹥ Al
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=4mol•L﹣1,则此温度下反应①的平衡常数为( )
|
| A. | 9 | B. | 16 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求写热化学方程式:
(1)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式 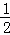 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=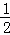 Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol .
Na2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol .
(2)25℃、101kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出表示丁烷燃烧热化学方程式 C4H10(g)+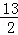 O2(g)=4CO2(g)+5H2O(l)△H=﹣16QkJ/mol .
O2(g)=4CO2(g)+5H2O(l)△H=﹣16QkJ/mol .
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ/mol
③H2(g)+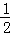 O2(g)═H2O(l)△H3=﹣285.8kJ/mol
O2(g)═H2O(l)△H3=﹣285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式 2C(s)+2H2(g)+O2(g)=CH3COOH(l);△H=﹣488.3kJ/mol .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是 ( )
A.6.02×1023是阿伏加德罗常数的近似值
B.阿伏加德常数个微粒的物质的量是1mol
C.1mol 12C原子的质量为12g
D.硫酸的摩尔质量是98克
查看答案和解析>>
科目:高中化学 来源: 题型:
胶体区别于其他分散系的本质特征是 ( )
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.葡萄糖属于单糖,能发生银镜反应
B.纤维素属于糖类,有甜味
C.油脂是高级脂肪酸的甘油酯,属于天然高分子化合物
D.蛋白质是人类必需的营养物质,在人体内最终水解成葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com