
【题目】(1)配平下列方程式
①_____Na+_____H2O =_____NaOH+_____H2↑
②_____Na2O2 +_____ CO2=_____ NaCO3 +_____O2↑
③_____KMnO4 +_____HCl(浓) =_____ KCl +_____MnCl2 +_____H2O + _____Cl2↑
④_____Al+_____H2O +_____NaOH =_____Na AlO2 +_____H2↑
(2)用双线桥法表示电子转移的数目和方向____________、__________
①2Na2O2 + 2H2O = 4NaOH + O2↑
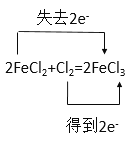
②2FeCl2 + Cl2 = 2FeCl3
【答案】2 2 2 1 2 2 2 1 2 16 2 2 8 5 2 2 2 2 3 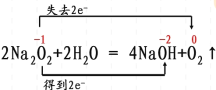
【解析】
配平氧化还原方程时先判断氧化剂、还原剂、氧化产物、还原产物,可利用化合价升降守恒来配平,再通过原子守恒来配平其他物质。
(1) ① Na由0价变为+1价,H由+1价变为0价,故方程为:![]() ,故答案为:2;2;2;1;
,故答案为:2;2;2;1;
②此为歧化反应,O化合价由-1价变为-2价和0价,故方程为:![]() ,故答案为:2;2;2;1;
,故答案为:2;2;2;1;
③Mn化合价由+7价下降为+2价,Cl化合价由-1价升高为0价,故方程为:![]() ,故答案为:2;16;2;2;8;5;
,故答案为:2;16;2;2;8;5;
④Al化合价由0价升高为+3价,H化合价有+1价下降为0价,故方程为:![]() ,故答案为:2;2;2;2;3;
,故答案为:2;2;2;2;3;
(2)①此化学方程式为歧化反应,O由+1价变为-2价和0价,双线桥表示为: ,故答案为:
,故答案为:
②Fe2+离子为还原剂化合价由+2变为+3价失去一个电子,Cl由0价变为-1价得到一个电子,用双线桥表示为: ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
A. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的![]()
C. 其他条件不变,将容器体积缩小至5 L,平衡正向移动,平衡常数增大
D. 以Y浓度变化表示的反应速率为0.000 5 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
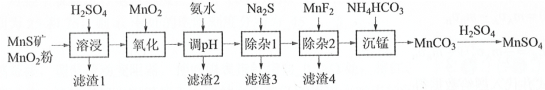
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素氧化物)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 molL1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)写出“沉锰”的离子方程式_____________。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=__________。
时,z=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大问题,合理的开发利用至关重要。
(1)丁烯是石油化工中的重要产物,正丁烷脱氢可制备1-丁烯:C4H10(g) =C4Hg(g) +H2(g) △H。 下表为该反应中所涉及物质的键能数据:
![]()
则△H=_______
(2)甲醇是未来重要的绿色能源之一,常见的合成反应为CO(g) +2H2(g)![]() CH3OH(g)H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
CH3OH(g)H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
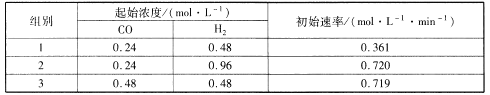
该反应速率的通式为v正=k正cm(CO).cn(H2)(k是与温度有关的速率常数)。由表中数据可确定反应速率通式中m和n分别_____、_____( 取正整数)。
(3)合成甲醇的原料气既可由煤气化提供,也可由天然气与水蒸气通过下列反应制备:CH4(g) + H2O(g) ![]() CO(g) +3H2(g)H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
CO(g) +3H2(g)H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
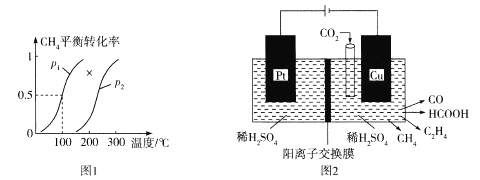
①p1____p2(填“<”“>”或“=")。
②已知压强为P1,温度为100°C时,反应达到平衡所需的时间为5min,则0~5min内用H2表示的平均反应速率为______;该温度下的平衡常数K=_______mol2·L-2。
(4)近年来,有人研究用温室气体二氧化碳通过电催化生成多种燃料,其工作原理如图2所示。
①写出Cu电极上产生乙烯的电极反应式:_____________;如果Cu电极上生成0.17molCO和0.33molHCOOH,则Pt电极上产生O2的物质的量为__________mol。
②HCOOH为一元弱酸,常温下将0.1mol·L-1HCOOH溶液与0.1mol·L-1NaOH溶液按体积比a:b混合(忽略溶液体积的变化),混合后溶液恰好显中性,则HCOOH的电离常数为______(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
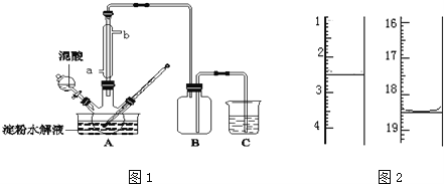
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图所示,下列说法正确的是( )
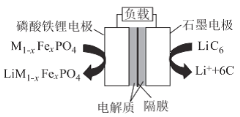
A.电池总反应为M1-xFexPO4+LiC6═LiM1-xFexPO4+6C
B.放电时,负极LiC6中碳元素失去电子变为单质
C.放电时,电流由石墨电极流向磷酸铁锂电极
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
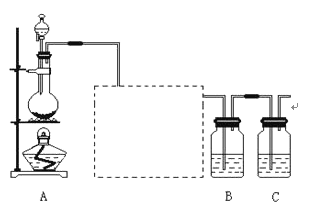
(1)装置A的分液漏斗中盛装的试剂是____,烧瓶中的化学反应方程式___。
(2)画出虚线框内的实验装置图______,所加试剂为______,装置的作用______。
(3)装置B中盛放的试剂是______ (选填下列所给试剂的代码),实验现象为______,该反应的离子方程式是______,该反应属于四种基本反应类型中的______反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2﹣比Cl﹣易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子.可说明氯比硫非金属性强的是______。
A.全部 B.②③④⑥⑦C.①②④⑤⑥D. 除 ①以外
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com