
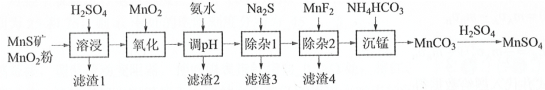
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素氧化物)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 molL1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)写出“沉锰”的离子方程式_____________。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=__________。
时,z=__________。
【答案】SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 将Fe2+氧化为Fe3+ 4.7 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O ![]()
【解析】
二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素氧化物)与硫酸反应,二氧化锰粉与硫化锰矿和硫酸发生氧化还原反应,SiO2不与H2SO4反应或SiO2与其他物质反应生成硅酸盐,加入MnO2氧化Fe2+,以便加入氨水时除掉铁元素,调节溶液pH值大于4.7小于6主要除掉铁元素和铝元素,除杂1主要除掉Zn2+和Ni2+,除杂2主要除掉Mg2+,得到Mn2+,加入碳酸氢铵溶液沉锰生成碳酸锰,加入硫酸生成硫酸锰。
(1)SiO2不与H2SO4反应或SiO2与其他物质反应生成硅酸盐,MnO2、MnS和H2SO4反应生成S、H2O和MnSO4,因此“滤渣1”含有S和SiO2;“溶浸”中二氧化锰与硫化锰反应的化学方程式MnO2+MnS+2H2SO4= 2MnSO4 + S + 2H2O;故答案为:SiO2(不溶性硅酸盐);MnO2+ MnS+2H2SO4=2MnSO4+S+2H2O。
(2)根据Mn2+、Fe2+的开始沉淀的pH值可知应将Fe2+氧化为Fe3+,避免除铁元素时沉淀锰,因此“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+;故答案为:将Fe2+氧化为Fe3+。
(3)“调pH”除铁和铝,应将pH控制在大于它们各种离子沉淀完全时的pH值以上,因此溶液的pH范围应调节为4.7~6之间;故答案为:4.7。
(4)“沉锰”是Mn2+与HCO3-反应生成碳酸锰,其离子方程式Mn2++2HCO3-= MnCO3↓ + CO2↑+H2O;故答案为:Mn2++2HCO3-= MnCO3↓ + CO2↑+H2O。
(5)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4,当x= y =![]() 时,根据化合价代数和为0得出
时,根据化合价代数和为0得出![]() ,则z=
,则z=![]() ;故答案为:
;故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③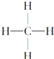 ④
④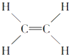 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的是⑤⑦⑧⑨
C. 属于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题:
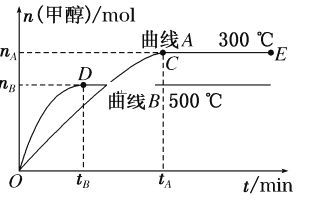
(1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值________(填“增大”“减小”或“不变”),平衡向__________方向移动。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)____________________。(用含相应字母的式子表示)
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(填选项字母)。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时![]() 增大
增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是_________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列说法不正确的是
A.中国天眼FAST用到的碳化硅是一种新型无机非金属材料
B.氯水放置数天后,漂白性和酸性均减弱
C.由石油的裂解可以得到乙烯、丙烯等主要化工基本原料
D.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因水中生成了硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C4H8O3的有机物能与NaHCO3溶液反应;0.1 mol该有机物与足量金属钠反应时可以收集到标况下的气体2.24 L。则符合上述条件的有机物有(不考虑立体异构)
A.2种B.3种C.4种D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
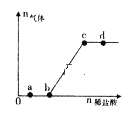
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。
提示:实验室中所用的少量氯气可以用下述原理制取:

2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
(1)氧化剂与还原剂物质的量之比为____________ ,氧化产物为____________。
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是(工业上用此原理制取漂白粉。)______________________,
(4)b处离子方程式是_______________________________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4 用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:__________________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式:
_____MnO4-+______H2C2O4+______ H+=____Mn2++_____CO2↑+_____ ________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平下列方程式
①_____Na+_____H2O =_____NaOH+_____H2↑
②_____Na2O2 +_____ CO2=_____ NaCO3 +_____O2↑
③_____KMnO4 +_____HCl(浓) =_____ KCl +_____MnCl2 +_____H2O + _____Cl2↑
④_____Al+_____H2O +_____NaOH =_____Na AlO2 +_____H2↑
(2)用双线桥法表示电子转移的数目和方向____________、__________
①2Na2O2 + 2H2O = 4NaOH + O2↑
②2FeCl2 + Cl2 = 2FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水剧烈反应,并产生能使品红褪色的气体。下列说法错误的是

A. S2Cl2的分子中的两个S原子均是sp3杂化
B. S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2
C. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O = SO2↑+3S↓+4HCl
D. S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com