
����Ŀ��һ�������£������Ϊ3L���ܱ������У�һ����̼��������Ӧ���ɼ״�(����ΪCu2O/ZnO)��CO(g)��2H2(g)![]() CH3OH(g)��������������������⣺
CH3OH(g)��������������������⣺
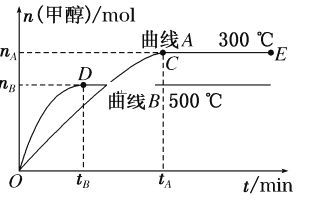
(1)��Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK��__________�������¶ȣ�Kֵ________(��������������С������������)��ƽ����__________�����ƶ���
(2)��500 �����ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)____________________�����ú���Ӧ��ĸ��ʽ�ӱ�ʾ��
(3)�������������������£�������E�����ϵ���ѹ����ԭ����1/2�������йظ���ϵ��˵����ȷ����________(��ѡ����ĸ)��
A��������Ũ�ȼ�С B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
C���״������ʵ������� D������ƽ��ʱ![]() ����
����
(4)���о�����Ӧ������������õ�ΪCu2O����Ӧ��ϵ�к�����CO2������ά�ִ���Cu2O�������䣬ԭ����_________________________________(�û�ѧ����ʽ��ʾ)��
���𰸡�![]() ��С �淴Ӧ
��С �淴Ӧ ![]() BC Cu2O��CO
BC Cu2O��CO![]() 2Cu��CO2
2Cu��CO2
��������
��1����֪CO(g)+2H2(g)CH3OH(g)����K=![]() ��500��ʱ�״������ʵ���С�����������¶ȣ�ƽ�����ƣ�����K��С���ʴ�Ϊ��
��500��ʱ�״������ʵ���С�����������¶ȣ�ƽ�����ƣ�����K��С���ʴ�Ϊ��![]() ����С���淴Ӧ��
����С���淴Ӧ��
��2����500�棬ƽ��ʱͼ�м״��ı仯��ΪnB�����Է�Ӧ���ĵ���������Ϊ��2nB����![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��3���������������������£��Դ���E�����ϵ���ѹ����ԭ����1/2����ѹǿ�������淴Ӧ���ʶ�����ƽ���������ƶ����״������ʵ������࣬���������ʵ�����С�������������С��ƽ��ʱ������Ũ�ȷ���������Ũ�ȱ�ֵ�������ʵ�����ֵ����������ƽ��ʱ![]() ��С����BC��ȷ���ʴ�Ϊ��BC��
��С����BC��ȷ���ʴ�Ϊ��BC��
��4����Ӧ��ϵ�к�����CO2������ά�ִ���Cu2O�������䣬һ����̼��������ͭ��Ӧ����ͭ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ��Cu2O+CO2Cu+CO2��������̼���Ʒ�Ӧ������У�������ά�ִ���Cu2O�������䣬�ʴ�Ϊ��Cu2O+CO2Cu+CO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����л�����Ľṹ��ʽ��
(1)2��4�һ�����___________________________��
(2)2��1,3����ϩ___________________________��
(3)3,4����2�촼___________________________��
(4)2,4,6�������ױ�___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۵�����(SN)x��K3C60�����ֲ�ͬ���͵ij������ϡ��ش��������⣺
(1)�ڻ�̬Kԭ���У�������͵Ŀչ���ķ�����_____________��
(2)S��N��K����Ԫ�صĵ�һ�������ɴ�С��˳����____________��
(3)(SN)x�������ƻ�ͭ�Ľ�������͵����ԣ���ṹ����ͼ��
![]()
��S2Cl2Ϊԭ�Ͽ���ȡ(SN)x��S2Cl2����S4N4 ![]() S2N2
S2N2 ![]() (SN)x
(SN)x
��(SN)x��Nԭ�ӵ��ӻ���ʽ��_________��(SN)x�ľ���������______��
��S2Cl2�ĽṹʽΪ________��
��AgԪ��λ�����ڱ���5���ڡ�IB�壬��̬Agԭ�ӵļ۵����Ų�ʽΪ__________��
(4)K3C60��������ϩ(C60)������ط�Ӧ���ɵ��Ρ�
����K3C60�����У�C603-�ѻ���ʽΪ���������ṹ��ÿ���������γ�4���������϶��8���������϶��K+����ڿ�϶�С������б�K+ռ�ݵĿ�϶�ٷֱ�Ϊ___________��
��C60����ʯ��Ϊͬ�������ݣ��Ƚ����ߵ��۷е㲢˵������____________��
��C60�Ľṹ��һ�ֶ����壬��ͼ��������Ķ�������������������Ĺ�ϵ��ѭŷ�����ɣ�������+����-�����=2��C60����������������κ������εĸ����ֱ�Ϊ_____��______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10 L���ܱ������У�1 mol X��1 mol Y���з�Ӧ��2X(g)��Y(g)![]() Z(g) ��H<0����Ӧ��60 s�ﵽƽ�Ⲣ����0.3 mol Z��������˵������ȷ����( )
Z(g) ��H<0����Ӧ��60 s�ﵽƽ�Ⲣ����0.3 mol Z��������˵������ȷ����( )
A. �����������䣬�����¶��淴Ӧ���ʼӿ죬����Ӧ���ʼ���
B. �����������䣬���������������20 L����Z��ƽ��Ũ�ȱ�Ϊԭ����![]()
C. �����������䣬�����������С��5 L��ƽ�������ƶ���ƽ�ⳣ������
D. ��YŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.000 5 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ��������Ӧ������ȷ����(����)
ѡ�� | A | B | C | D |
װ�� |
|
|
|
|
���� | ��֤��Al(OH)3�����ڰ�ˮ | ��֤���ǽ����ԣ�Cl>C>Si | ��֤���������ⸯʴ | ϴ��ƿ�в����İ�ɫ������BaSO3 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������У�������һ��������ͬ��Ԫ��ԭ�ӵ���(����)
A.3p�ܼ���һ���չ���Ļ�̬ԭ�Ӻͺ�������Ų�Ϊ1s22s22p63s23p2��ԭ��
B.M��ȫ������N��Ϊ4s2��ԭ�Ӻͺ�������Ų�Ϊ1s22s22p63s23p63d64s2��ԭ��
C.�����������Ǻ������������![]() ��ԭ�Ӻͼ۵����Ų�Ϊ4s24p5��ԭ��
��ԭ�Ӻͼ۵����Ų�Ϊ4s24p5��ԭ��
D.2p�ܼ���һ��δ�ɶԵ��ӵĻ�̬ԭ�Ӻͼ۵����Ų�Ϊ2s22p5��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(DMP)��һ���ܻ�������Է�������Ϊ194�����˺��������һ����Σ������ṹ�ɱ�ʾΪ![]() (����RΪ����)ʵ���������·����ɵõ�DMP��
(����RΪ����)ʵ���������·����ɵõ�DMP��
![]()
��ش�
(1)����C�й����ŵ�����Ϊ_____��
(2)�����й�DMP��˵��������ȷ����_______��(����ĸ���)
A��DMP�ķ���ʽΪC10H12O4
B��DMP���Է���ȡ�����ӳɡ������ȷ�Ӧ
C��DMP��ˮ�е��ܽ�Ȳ���
(3)B���Ҷ���(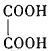 )��һ�������¿������ʵ���1��1������Ӧ���ɸ߷��ӻ�����ø߷��ӻ�����Ľṹ��ʽΪ______��
)��һ�������¿������ʵ���1��1������Ӧ���ɸ߷��ӻ�����ø߷��ӻ�����Ľṹ��ʽΪ______��
(4)��ҵ�����ڶ��ױ�(![]() )Ϊԭ������������(
)Ϊԭ������������(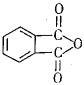 )����ʹ����ij����һ�������·�Ӧ��ȡDMP��������ô���ȡDMP�Ļ�ѧ����ʽΪ________��
)����ʹ����ij����һ�������·�Ӧ��ȡDMP��������ô���ȡDMP�Ļ�ѧ����ʽΪ________��
(5)���㻯����E��C��Ϊͬ���칹�壬��lmo E������������Һ��Ӧ�������2mol Ag����E���ܵĽṹ��ʽΪ______��BҲ���ڶ���ͬ���칹�壬��������������B��ͬ���칹����______�֡�
��l mol�л��������2mol NaOH��Ӧ
�ڱ����ϵ�һ�ȴ���ֻ��һ�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ���������Ϊ�ϳ���������Ԫ�������ϵ�ԭ�ϣ���ҵ�Ͽ�����Ȼ�������̷������̿���Fe��Al��Mg��Zn��Ni��Si��Ԫ��������Ʊ�����������ͼ��ʾ���ش��������⣺
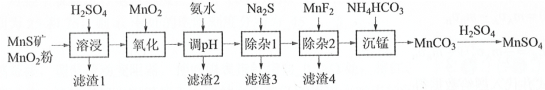
��ؽ�������[c0(Mn+)=0.1 molL1]�γ��������������pH��Χ���£�
�������� | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
��ʼ������pH | 8��1 | 6��3 | 1��5 | 3��4 | 8��9 | 6��2 | 6��9 |
������ȫ��pH | 10��1 | 8��3 | 2��8 | 4��7 | 10��9 | 8��2 | 8��9 |
(1)������1������S��__________________________��д�����ܽ����ж������������̷�Ӧ�Ļ�ѧ����ʽ____________________________________________________��
(2)��������������������MnO2�������ǽ�________________________��
(3)����pH��������������Һ��pH��ΧӦ����Ϊ_______~6֮�䡣
(4)д�������̡������ӷ���ʽ_____________��
(5)��״��������Ԫ���Ͽ���Ϊ����ӵ���������ϣ��仯ѧʽΪLiNixCoyMnzO2������Ni��Co��Mn�Ļ��ϼ۷ֱ�Ϊ+2��+3��+4����x=y=![]() ʱ��z=__________��
ʱ��z=__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�

�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com