
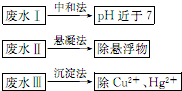
 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.分析 (1)天然水中溶有氧气、二氧化碳等;
(2)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的;
(3)蒸馏水为纯水,导电性很弱;
(4)工业中利用反渗透法通过施加一定压力使水分子通过半透膜而将大分子或离子截留,而获得纯净水;利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果;
(5)①中和法利用二氧化碳和碱反应的性质可除去OH-;
②HCO3-可与Al3+发生互促水解反应;
③由Hg的摩尔质量可以计算出100ml排放液中含Hg2+的质量,据此判断.
解答 解:(1)天然水中溶有氧气、二氧化碳等,故答案为:O2、CO2;
(2)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾或硫酸铝,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,故答案为:明矾、硫酸铝;
(3)蒸馏水为纯水,导电性很弱,则检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率,故答案为:电导率或电阻率;
(4)电渗析法是一种利用离子交换膜进行海水淡化的方法.在外加电场的作用下,水溶液中阴、阳离子会分别向两极移动,如果在中间加上一种交换膜,就可能达到分离浓缩的目的.所以电渗析法净化水时,使离子通过半透膜的推动力是电势差或电场力,故答案为:反渗透法;电势差(或电场力);
(2)①pH接近7,用CO2处理,生成HCO3-,则反应的离子方程式为OH-+CO2=HCO3-,故答案为:OH-+CO2=HCO3-;
②HCO3-和Al3+发生相互促进的水解,生成CO2和Al(OH)3,从而增强净水效果,故答案为:HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强;
③100ml水中,n(Hg2+)=3×10-7mol,则m(Hg2+)=3×10-7mol×200.6g/mol=6.03×10-5g,所以1L水中含有m(Hg2)=6.03×10-4g>0.05mg,所以没有达到排放标准,故答案为:6.03×10-4;否.
点评 本题是一道化学和生活相结合的题目,注重知识的迁移应用,能较好的考查学生分析和解决问题的能力,为高考常见题型和高频考点,题目信息量较大,注意把握题给信息,答题时仔细审题,难度中等.


科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.2K+2H2O=2KOH+H2↑
B.Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3
C.2Cu(NO3)2=2CuO+4NO2↑ +O2↑
D.3CO+Fe2O3=2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

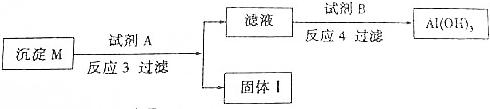
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
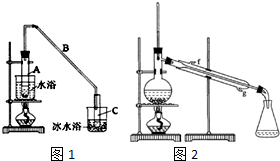 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.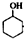 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O| 密度(g.cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.096 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.081 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2通入正极区 | |
| B. | 总反应为:2H2+O2═2H2O | |
| C. | 正极发生氧化反应 | |
| D. | 负极区电极反应为 2H2+4OH--4e-═4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
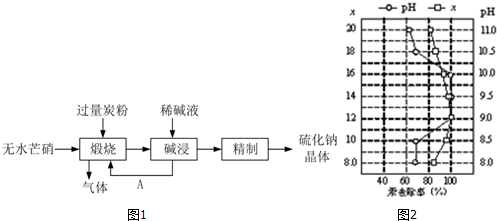
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
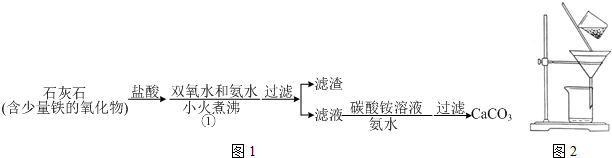
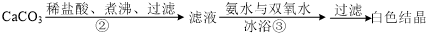
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
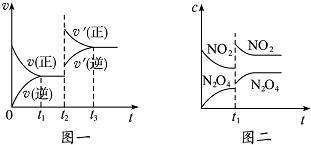
| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
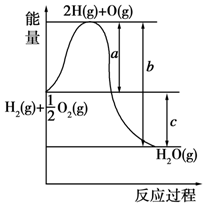 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com