
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
查看答案和解析>>
科目:高中化学 来源:河北省模拟题 题型:填空题



 ;操作过程中溶液体积的变化忽略不计。
;操作过程中溶液体积的变化忽略不计。 查看答案和解析>>
科目:高中化学 来源: 题型:
目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点。
(1)在处理水的过程中,Na2FeO4起到杀菌、消毒、净水的作用,请说明应用了Na2FeO4的哪些性质:__________________________________________________________________________
(2) 某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
| 离子 | SO | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
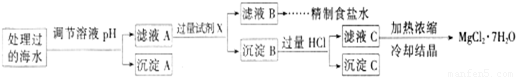
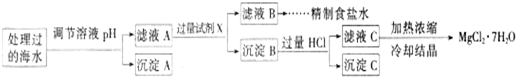
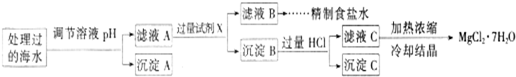
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:

Ksp[Fe(OH)3]=1.0×10-38;Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计。
① 表格中的a________0.16(填“<”、“>”或“=”)。
② 沉淀A的组成为________(填化学式);在调节溶液pH时,理论上应调节的pH的范围是________。
③ 加入的过量试剂X为____________________(填化学式)。
④ 加入过量HCl的作用为_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com