
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
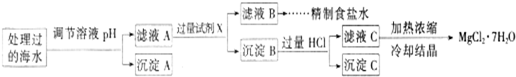


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是
如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ______Cu2+______Fe2++______H++______S
______Cu2+______Fe2++______H++______S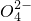
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
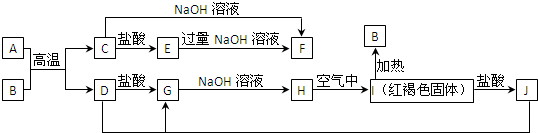
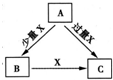 A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:
A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:单选题
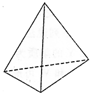 意大利科学家获得了极具有理论研究意义的N4分子,N4分子结构如图所示.下列说法正确的是
意大利科学家获得了极具有理论研究意义的N4分子,N4分子结构如图所示.下列说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
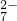 的废水的原理如下:向含Cr2O
的废水的原理如下:向含Cr2O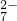 的酸性废水中加入FeSO4?7H2O,将Cr2O
的酸性废水中加入FeSO4?7H2O,将Cr2O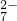 还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeⅡ[FeⅢx?CrⅢ2-x]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀.处理含1mol Cr2O
还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeⅡ[FeⅢx?CrⅢ2-x]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀.处理含1mol Cr2O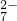 的废水至少需要加入a mol FeSO4?7H2O.下列结论正确的是
的废水至少需要加入a mol FeSO4?7H2O.下列结论正确的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com