



 ;操作过程中溶液体积的变化忽略不计。
;操作过程中溶液体积的变化忽略不计。  名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:0103 期中题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:辽宁省模拟题 题型:填空题
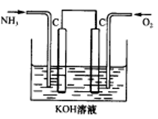
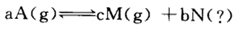

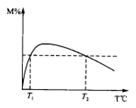
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
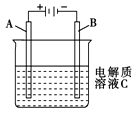
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:河北省期末题 题型:不定项选择题
查看答案和解析>>
科目:高中化学 来源:江苏期中题 题型:单选题
 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com