
【题目】苹果汁是人们喜爱的饮料,现榨的苹果汁在空气中放置一会儿会 由淡绿色(Fe2+ )变为黄色(Fe3+)。若榨汁时加人维生素C,可有效防止这种现象发生,这说明维生素C具有
A.还原性B.碱性C.氧化性D.酸性
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
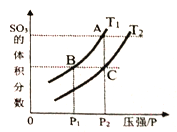
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组的同学在完成课本乙醇氧化制乙醛的实验后,改进了实验方案(如图),进行如下实验操作(顺序已打乱):
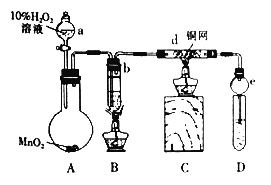
①点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热;
②向圆底烧瓶中滴加10%过氧化氢溶液;
③连接好仪器,检验装置的气密性;
④正确添加试剂;
⑤点燃C装置中的酒精灯
根据以上实验内容回答下列问题:
(1)实验操作顺序是 _____________________(填序号).
(2)装置e的作用是_____________________________________;
(3)写出d中发生反应的化学方程式____________________________________________;
(4)为检验D中收集的产物中是否含有乙醛,甲同学利用银氨溶液检验,请写出化学方程式_________________________________________________________;
(5)乙同学在一支试管中先加入2mL5%的CuSO4,滴加4﹣5滴NaOH溶液,再滴加几滴D中溶液,在酒精灯上加热,未出现砖红色沉淀,从而断定无乙醛生成.请你判断乙同学的说法是否合理,并说明理由___________________________________________________;
(6)若试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明液体中还含有____,要除去该物质,可先在混合液中加入_____(填写下列选项中的字母),然后再通过_____(填操作名称)即可除去.
A.饱和NaCl溶液 B.C2H5OH C.NaHCO3溶液 D.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
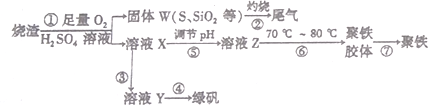
(1)过程③中,需要加入的物质名称是____________________。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的___________吸收。
a.浓硫酸 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程①中,FeS和O2、H2SO4反应的化学方程式为____________________。
(4)过程④的实验操作是____________________。
(5)过程⑥中,将溶液Z加热到70℃~80℃,目的是 ___________________。
(6)某种脱硫脱硝工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设废气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________________。
(7)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液:③过滤、洗涤、干燥、称量,得固体质量为3.495g,若该聚铁主要成分为[Fe(OH)SO4]a,则该聚铁中铁元素的质量分数为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com