
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
【答案】 1∶3 1∶1 变小 不变 逆向 向左移动 小于
【解析】试题分析:在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,正反应为放热反应。
2NH3(g) ΔH=-92.4 kJ·mol-1,正反应为放热反应。
(1)因为原始投料时N2和H2的物质的量之比为1:3,在反应过程中,两者的变化量之比也是1:3,所以当反应达到平衡时,N2和H2的物质的量之比必然还是1:3,所以其浓度比是1:3;转化率等于变化量占起始量的百分数,原始投料时N2和H2的物质的量之比为1:3,两者的变化量之比也是1:3,所以N2和H2的转化率之比是1:1。
(2)升高平衡体系的温度(保持体积不变),化学平衡将向吸热反应方向移动,即向逆反应方向移动,混合气体的总物质的量增大,而质量守恒,所以混合气体的平均相对分子质量变小。因为质量守恒、体积不变,所以密度不变。
(3)当达到平衡时,充入氩气,并保持压强不变,则容器的体积必须增大,反应混合物中各组分的浓度都要减小,这相当于减压,化学平衡将气体体积增大的方向移动,即逆向)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将向吸热反应方向移动,即向左移动。达到新平衡后,容器内温度小于原来的2倍。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,现榨的苹果汁在空气中放置一会儿会 由淡绿色(Fe2+ )变为黄色(Fe3+)。若榨汁时加人维生素C,可有效防止这种现象发生,这说明维生素C具有
A.还原性B.碱性C.氧化性D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置,如图为电池示意图,该电池电极表面镀层铂粉(铂粉吸附气体的能力强,性质稳定),请回答下列问题:
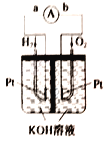
(1)该装置能量转化的主要形式是_________。
(2)在导线中电子流动方向为_________(用a、b表示)。
(3)负极反应式为_________ 。
(4)电极表面镀铂粉的目的:_________。
(5)若将该电池中的KOH溶液换为稀硫酸,内电路溶液中H+向_________ (填“正极”或“负极”)移动,电池工作时正极的反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由水电离的c(H+)=10-14mol/L的溶液中,一定能大量共存的离子组是( )
A. K+、Fe2+、SO![]() 、MnO B. Na+、Cl-、NO、SO
、MnO B. Na+、Cl-、NO、SO![]()
C. Al3+、NH、Cl-、SO![]() D. Na+、AlO、Br-、Cl-
D. Na+、AlO、Br-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】疏松的糕点、饼干、面包等在制作过程中都使用了疏松剂。疏松剂受热分解,产生的气体使食品酥脆、松软。下列物质可作为食品制作过程中使用的疏松剂的是
A. NaCl B. Na2CO3 C. NaHCO3 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧有较强氧化性,能加速人体衰老,被称为“生命杀手”。科学家尝试用Na2SeO3消除人体内的活性氧,则Na2SeO3的作用是( )
A. 氧化剂 B. 还原剂 C. 既是氧化剂又是还原剂 D. 以上均不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥食盐晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3·H2O,其中能够导电的是 ,强电解质是 ,弱电解质是 ,非电解质是 。
(2)H2S溶于水的电离方程式为 。
①向H2S溶液中加入CuSO4溶液时,电离平衡向 移动,c(H+) ,c(S2-) 。
②向H2S溶液中加入NaOH固体时,电离平衡向 移动,c(H+) ,c(S2-) 。
③若将H2S溶液加热至沸腾,c(H2S) 。
④若要增大H2S溶液中c(S2-),最好加入 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 称量NaOH时,称量物放在称量纸上,置于托盘天平的左盘中
C. 过滤时,漏斗下端紧贴烧杯内壁
D. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com