
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ������ͼΪ���ʾ��ͼ���õ�ص缫����Ʋ㲬��(�����������������ǿ�������ȶ�)����ش��������⣺
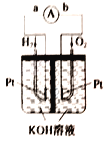
��1����װ������ת������Ҫ��ʽ��_________��
��2���ڵ����е�����������Ϊ_________(��a��b��ʾ)��
��3��������ӦʽΪ_________ ��
��4���缫����Ʋ��۵�Ŀ����_________��
��5�������õ���е�KOH��Һ��Ϊϡ���ᣬ�ڵ�·��Һ��H+��_________ (��������������������)�ƶ�����ع���ʱ�����ķ�ӦʽΪ_________��
���𰸡� �ɻ�ѧ��ת��Ϊ���� ��a��b H2��2OH����2e����2H2O ����缫��λ�������H2��O2���������ӿ�缫��Ӧ���� ���� O2��4H+��4e����2H2O
����������1��ԭ��ص�ʵ��Ϊ��ѧ��ת���ɵ��ܣ���2������ȼ�ϵ���ܷ�ӦΪ2H2+O2=2H2O������HԪ�صĻ��ϼ۴��������+1�ۣ�ʧȥ���ӣ������Ӵ�a����b����3������Ϊʧȥ���ӵ�һ������H2ʧ��������H����������Һ�Ǽ��Եģ�������ӦʽΪ H2��2OH����2e����2H2O����4���缫����Ʋ��۵�Ŀ��������缫��λ�������H2��O2���������ӿ�缫��Ӧ��������5�������õ���е�KOH��Һ��Ϊϡ���ᣬ�ڵ�·��Һ��H+����������ع���ʱ�����ķ�ӦʽΪO2��4H+��4e����2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g),��Ӧ�������¡�
2P(s)+3Cl2(g)=2PCl3(g) ��H=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ��H=-798kJ/mol
��̬PCl5������̬PCl3��Cl2���Ȼ�ѧ����ʽΪ________.
��2����ͬ�¶��·�ӦCO(g)+H2O(g)![]() CO2(g)+H2(g) ��H1��ƽ�ⳣ�����±���ʾ��
CO2(g)+H2(g) ��H1��ƽ�ⳣ�����±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
����H1______0(����<����>��)����500��ʱ���ѵ����ʵ���Ũ�ȵ�CO��H2O(g)���뷴Ӧ�������ﵽƽ��ʱc(CO)=0.005mol/L��c(H2)=0.015mol/L,��CO��ƽ��ת����Ϊ______��
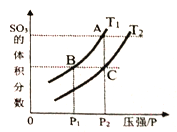
��3����һ������ľ����ܱ������У����ڷ�Ӧ2SO2(g)+O2(g)![]() 2SO3(g) ��H<0,�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_____________��
2SO3(g) ��H<0,�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_____________��
A.SO2��SO3Ũ�����
B.�����л��������ܶȱ��ֲ���
C.������������¶ȱ��ֲ���
D.SO3������������SO2�������������
���¶�ΪT1��T2ʱ��ƽ����ϵSO3�����������ѹǿ�仯��������ͼ��ʾ����T1____T2 (����>������<")��������_____�������ӿ�����Ӧ�����ʣ����˸ı��¶ȣ���������_______������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����������᳧����(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)�Ʊ�����(��ʽ�������ľۺ���)���̷�(FeSO4��7H2O)����������£�
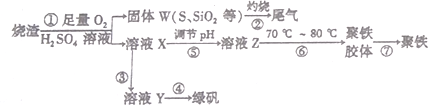
��1�����̢��У���Ҫ���������������____________________��
��2�����̢��в�����β����Դ��������Ⱦ����ѡ�������Լ��е�___________������
a.Ũ���� b.����ˮ c.NaOH��Һ d.Ũ����
��3�����̢�����FeS��O2��H2SO4��Ӧ�Ļ�ѧ����ʽΪ____________________��
��4�����̢ܵ�ʵ�������____________________��
��5�����̢���������ҺZ���ȵ�70����80����Ŀ���� ___________________��
��6��ij���������������н���������������һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ������������е�SO2��NO2�����ʵ���֮��Ϊ1��1����÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
��7��ʵ����Ϊ�ⶨ���õ��ľ�����Ʒ����Ԫ�ص�������������������ʵ�顣���÷�����ƽ��ȡ��Ʒ2.700 g���ڽ���Ʒ����������������������Ȼ�����Һ���۹��ˡ�ϴ�ӡ�����������ù�������Ϊ3.495g�����þ�����Ҫ�ɷ�Ϊ[Fe(OH)SO4]a����þ�������Ԫ�ص���������Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ڻ�������������ұ������ѧ�о��ȷ�������ҪӦ�á�
(1)��ҵ���õ�������������ķ�������ȡ���������������������۵�ܸ�(Լ2045��)����ʵ�������У�ͨ���������ۼ�����ʯNa3AlF6) ��1000�����ҾͿ��Եõ������塣
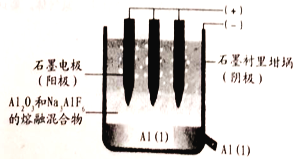
��д�����ʱ�����ĵ缫��Ӧʽ:___________��
������������������ʯī�����ģ�ԭ����___________��
(2) ���ʳ��ˮ�����ƹ�ҵ�Ļ�����
�ٵ������ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥMg2+��Ca2+,Ҫ������Լ��ֱ�Ϊ____��_____�����ʱ��������Ӧ����Ҫ������___________��
�����ʱ�����������������pH��2��3���ñ�Ҫ�����ֺͷ�Ӧ����ʽ˵��ԭ��: ___________��
��3��Cu2O�ǰ뵼����ϣ���ҵ�ϳ��õ�ⷨ��ȡ�����װ������ͼ��ʾ��
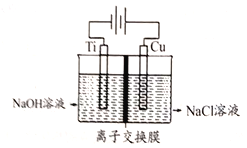
���װ���в������˽���Ĥ����������OH-��Ũ�ȶ��Ʊ�����Cu2O�������ӽ���Ĥ��____(����������������)���ӽ���Ĥ����������Cu2O�ĵ缫��ӦʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�߷��ӻ�����R�Ľṹ��ʽ����ͼ�������й�R��˵����ȷ����
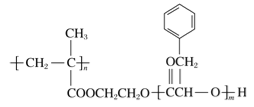
A. R��һ�ֵ���ķ���ʽΪC9H10O2
B. R��ȫˮ�����������ΪС�����л���
C. ����ͨ���Ӿ۷�Ӧ�����۷�Ӧ�ϳ�R
D. ���������£�1 mol R��ȫˮ������NaOH�����ʵ���Ϊ2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������100mL1mol/Lϡ���ᣬ������Ũ�ȱ�Ϊ2mol/L�����Բ�ȡ�Ĵ�ʩΪ�� ��
A. ������ͨ������22.4LHCl���� B. ��������ʹ��Һ�����Ϊ50mL
C. ����������50mLˮ D. ����5mol/L����100mL���ٽ���Һ���ϡ�͵�300mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ĵ��ʣ��Dz������Ļ�����Ʒ֮һ���¹��˹�����1905�귢���˺ϳɰ��ķ�������ϳ�ԭ��Ϊ��N2(g)��3H2(g)![]() 2NH3(g)����H����92.4 kJ/mol������˻����1918��ŵ������ѧ�����ܱ������У�ʹ2 mol N2��6 mol H2��Ϸ�����Ӧ��N2(g)��3H2(g)
2NH3(g)����H����92.4 kJ/mol������˻����1918��ŵ������ѧ�����ܱ������У�ʹ2 mol N2��6 mol H2��Ϸ�����Ӧ��N2(g)��3H2(g)![]() 2NH3(g)(����ӦΪ���ȷ�Ӧ)��
2NH3(g)(����ӦΪ���ȷ�Ӧ)��
��1������Ӧ�ﵽƽ��ʱ��N2��H2��Ũ�ȱ���___________��N2��H2��ת���ʱ���_____________��
��2������ƽ����ϵ���¶�(�����������)����������ƽ����Է�������____________���ܶ�_____________��(���������������С������������)
��3�����ﵽƽ��ʱ�����������������ѹǿ���䣬ƽ�⽫_____________(����������������������������)�ƶ���
��4�����������ݡ����ȣ�����ʹ�������¶�Ѹ������ԭ����2����ƽ�⽫________(���������ƶ������������ƶ����������ƶ���)���ﵽ��ƽ����������¶�________(��������������С��������������)ԭ����2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֲ�ͬ����£����淴ӦA��g��+2B��g��C��g��+D��g���ķ�Ӧ�������£����з�Ӧ���е�������
A. v��A��=0.15 mol/��L��min�� B. v��B��=0.6 mol/��L��min��
C. v��C��=0.4 mol/��L��min�� D. v��D��=0.02 mol/��L��s��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com