
【题目】在由水电离的c(H+)=10-14mol/L的溶液中,一定能大量共存的离子组是( )
A. K+、Fe2+、SO![]() 、MnO B. Na+、Cl-、NO、SO
、MnO B. Na+、Cl-、NO、SO![]()
C. Al3+、NH、Cl-、SO![]() D. Na+、AlO、Br-、Cl-
D. Na+、AlO、Br-、Cl-
【答案】B
【解析】由水电离的c(H+)=10-14mol/L的溶液呈酸性或碱性。A. 若溶液呈酸性,Fe2+、MnO 、H+发生反应,若溶液呈碱性,Fe2+、OH-发生反应,故A在由水电离的c(H+)=10-14mol/L的溶液中,一定不能大量共存;B. 无论溶液呈酸性还是碱性,Na+、Cl-、NO、SO![]() 都不发生反应,故B在由水电离的c(H+)=10-14mol/L的溶液中,一定能大量共存;C. 若溶液呈碱性,Al3+与OH-、NH与OH-发生反应,故C在由水电离的c(H+)=10-14mol/L的溶液中,不一定能大量共存;D. 若溶液呈酸性,H+、AlO发生反应,故D在由水电离的c(H+)=10-14mol/L的溶液中,不一定能大量共存。故选B。
都不发生反应,故B在由水电离的c(H+)=10-14mol/L的溶液中,一定能大量共存;C. 若溶液呈碱性,Al3+与OH-、NH与OH-发生反应,故C在由水电离的c(H+)=10-14mol/L的溶液中,不一定能大量共存;D. 若溶液呈酸性,H+、AlO发生反应,故D在由水电离的c(H+)=10-14mol/L的溶液中,不一定能大量共存。故选B。


科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物R的结构简式如右图,下列有关R的说法正确的是
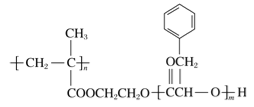
A. R的一种单体的分子式为C9H10O2
B. R完全水解后的生成物均为小分子有机物
C. 可以通过加聚反应和缩聚反应合成R
D. 碱性条件下,1 mol R完全水解消耗NaOH的物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100mL1mol/L稀盐酸,欲将其浓度变为2mol/L,可以采取的措施为( )
A. 向其中通入标况下22.4LHCl气体 B. 加热蒸发使溶液体积变为50mL
C. 加热蒸发掉50mL水 D. 加入5mol/L盐酸100mL,再将溶液体积稀释到300mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂与收集气体的实验不能达到实验目的的是( )

选项 | 实验目的 | X | Y |
A | 除去N2中的Cl2,并收集N2 | FeSO4 | H2O |
B | 除去CO中的CO2,并收集CO | NaOH | H2O |
C | 除去NO中的NO2,并收集NO | H2O | H2O |
D | 除去Cl2中的HCl,并收集纯净的Cl2 | NaCl | H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol,他因此获得了1918年诺贝尔化学奖。密闭容器中,使2 mol N2和6 mol H2混合发生反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)。
2NH3(g)(正反应为放热反应)。
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是_____________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____________,密度_____________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】管道煤气的主要成分是CO,H2和少量甲烷.相应的热化学方程式为
2H2(g)+O2(g)═2H2O(l);△H=﹣571.6kJmol﹣1
2CO(g)+O2(g)═2CO2(g);△H=﹣566kJmol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=﹣890.3kJmol﹣1
当使用管道煤气的用户改烧天然气后,在相同条件下燃烧等体积的燃气,理论上所获得的热值,后者大约是前者的( )
A.0.8倍
B.1.3倍
C.1.6倍
D.3.1倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种离子化合物分别由Ba2+、NH4+、Na+、Mg2+中的一种和OH-、HSO4-、CO32-、Cl-中的一种组成。为确定其组成,某兴趣小组做了以下实验:
①配制浓度均为0.1mol/L的四种溶液,测其PH,其中B的PH大于13,C的PH大于7。
②将足量的B溶液与A溶液混合并微热,生成了白色沉淀与刺激性气味气体。
据此请回答下列问题:
(1)D的化学式为____,A在水中的电离方程式为____;
(2)A与B按物质的量之比2:1在水溶液中进行反应的离子方程式为___;
(3)已知CH3COONH4溶液呈中性,如将等浓度、等体积的A溶液滴加到C溶液中,所得混合液呈____性(填“酸”、“碱”、“中”),各离子浓度由大到小的顺序为____;
(4)将C和D的溶液分别蒸干并灼烧,所得固体分别是____。(填化学式)
(5)分别向含有0.15molB的溶液中加入100mL和200mL的A溶液并加热收集生成的气体,所得气体在标准状况下的体积均为VL,则V等于____,所加A溶液的物质的量浓度为____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com