
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是

A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
【答案】D
【解析】
第三周期简单离子中半径最小的是铝离子,所以C为铝;0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液pH分别为1、lg5、13,分别为一元强酸、二元强酸、一元强碱,其中A、B原子序数比铝小,只可能分别为氮和钠,D为硫,则E为氯;
A.铝制容器可盛装浓硫酸和浓硝酸,因为能被钝化,A项不符合题意;
B.AE3、D2E2分别为NCl3、S2Cl2,二者电子式分别为![]() 、
、![]() , B项不符合题意;
, B项不符合题意;
C.钠、硫、氯元素均可形成能作漂白剂的物质,如SO2、Na2O2、Cl2、ClO2、HClO,C项不符合题意;
D.工业上制备铝不能电解熔融的氯化铝,由于氯化铝为共价化合物,熔融状态下不导电,而是电解熔融的氧化铝, D项符合题意。
本题答案选D。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。
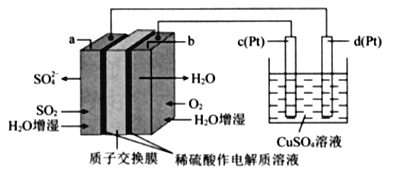
下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与l00mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积己折算为标准状况下的体积)。下列分析正确的是

A. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
B. OE段表示的平均速率最快
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
D. F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醇和乙酸的说法中,正确的是
A.乙醇和乙酸分子中都含有C=O键B.乙醇和乙酸互为同分异构体
C.乙醇和乙酸均能使紫色石蕊试液变红D.乙醇和乙酸相互之间能溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H18O2的酯在酸性条件下水解,所得的羧酸和醇在相同条件下二者蒸汽的密度相同,符合此条件的酯的同分异构数目为
A. 2 B. 8 C. 10 D. 16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图的装置中,干燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛装某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是

A.CO2(饱和NaHCO3溶液)无色喷泉
B.NO2(H2O含石蕊)红色喷泉
C.NH3(H2O含石蕊)蓝色喷泉
D.HCl(AgNO3溶液)白色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的Na2CO3·mH2O和BaCl2·nH2O的混合物3.68g,加入足量水搅拌,经充分反应后可得1.97g沉淀。则m和n值分别是
A.10和2B.7和3C.3和1D.1和2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4 +16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出上述反应电子转移的方向和数目。____
(2)该反应中氧化剂是___,被氧化的元素是___,若有1mol的KMnO4参加反应,则可以氧化___mol的HCl,转移的电子数目为____mol,得到的氯气的体积为___L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com