
【题目】实验室可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4 +16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出上述反应电子转移的方向和数目。____
(2)该反应中氧化剂是___,被氧化的元素是___,若有1mol的KMnO4参加反应,则可以氧化___mol的HCl,转移的电子数目为____mol,得到的氯气的体积为___L(标准状况下)。
【答案】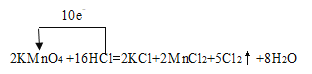 KMnO4 -1价的Cl 5 5 56
KMnO4 -1价的Cl 5 5 56
【解析】
在氧化还原反应中,
氧化剂具有氧化性,得电子化合价降低,被还原,发生还原反应,得到还原产物;
还原剂具有还原性,失电子化合价升高,被氧化,发生氧化反应,得到氧化产物;
(1)该反应中Mn元素化合价从+7价降低到+2价,则KMnO4为氧化剂,得电子被还原,氯元素化合价从-1价升高到0价,失电子被氧化,若有2mol KMnO4参加反应,转移电子物质的量为5×2mol =10mol,据此用用单线桥标出上述反应电子转移的方向和数目;
(2)该反应中Mn元素化合价降低,则KMnO4为氧化剂,氯元素化合价升高,HCl为还原剂,但只有部分HCl为还原剂,若有2mol的KMnO4参加反应,由化学计量之比知,只有10mol HCl作还原剂,同时生成5mol Cl2,转移的电子数目为2mol×5=10mol;
(1)该反应中Mn元素化合价从+7价降低到+2价,则KMnO4为氧化剂,氯元素化合价从-1价升高到0价,若有2mol KMnO4参加反应,转移电子物质的量为5×2mol =10mol,则用单线桥标出该反应电子转移的方向和数目为;
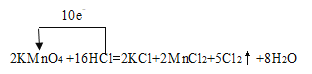 ;
;
(2)该反应中Mn元素化合价降低,则KMnO4为氧化剂,氯元素化合价升高,HCl为还原剂,但只有部分HCl为还原剂,若有2mol的KMnO4参加反应,由化学计量之比知,只有10mol HCl作还原剂,则可以氧化10mol的HCl,生成5mol Cl2,则由列比例计算得,若有1mol的KMnO4参加反应,由化学计量之比知,只有5mol HCl还原剂,则可以氧化5mol的HCl,生成2.5mol Cl2,标况下体积为:V=nVm=2.5mol×22.4L/mol=56L,转移的电子数目为5mol。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,0.1mol·L1A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的pH变化情况如图,则下列说法中不正确的是

A. C制的容器可盛装A和D的最高价含氧酸的浓溶液
B. AE3、D2E2分子中所有原子最外层均达到8电子结构
C. B、D、E的单质或者化合物中都可能有能作漂白剂的物质
D. 工业上分别电解熔融的B与E、C与E形成的化合物制备B、C单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列四个图像:

下列反应中全部符合上述图像的反应是 ( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH1<0
2NH3(g) ΔH1<0
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH2>0
2SO2(g)+O2(g) ΔH2>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH3<0
4NO(g)+6H2O(g) ΔH3<0
D. H2(g)+ CO(g)![]() C(s)+H2O(g) ΔH4>0
C(s)+H2O(g) ΔH4>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物用途广泛,其中NaCl和HCl是两种重要的含氯化合物。
(1)NaCl的电子式为___,HCl的电子式___。
(2)工业上生产氯气的方法是电解饱和食盐水,写出该反应的化学方程式:___,电解时氯气在___极得到,可用___来检验其存在。
(3)实验室制备氯化氢气体的化学方程式为___。
(4)如图为H2和Cl2燃烧的反应能量变化示意图,请根据此图写出该反应的热化学方程式:___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含铁的氯化物、CuCl2、SiO2、MnO2等杂质。工业上以卤块为原料可制得轻质氧化镁,工艺流程如图所示:

已知:生成氢氧化物沉淀的pH如下表所示:
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 6.0 | 8.0 |
Mn(OH)2 | 7.3 | 9.3 |
Mg(OH)2 | 9.1 | 11.1 |
请回答下列问题
(1)滤渣1的成分有______________________(填化学式)。加入试剂1的目的是___________。
(2)步骤“加NaOH”需要调节pH值的范围为______________________。
(3)沉淀1的成分为______________________ (填化学式),步骤“加水煮沸”发生反应的化学方程式为______________________。
(4)步骤“加水煮沸”不能时间太长,原因是______________________。
(5)最近研究表明,常温下在含有Mg2+浓度为1.5mol/L的溶液中加入2倍于Mg2+的物质的量的NH4HCO3,控制pH值在9.5左右,镁的沉淀率能达到99%。产物为一种含结晶水的复盐,可用于煅烧制取轻质氧化镁,经XDR(X射线衍射)分析该复盐含水与含镁的物质的量相等。写出制取该复盐的离子方程式:_________________________________。
(6)除了OH-之外,S2-也是一种常见的金属离子沉淀剂。本质原因是一些金属硫化物的溶解度极小。已知:25℃时,CuS的溶度积为4×10-36,H2S的Ka1=1.25×10-7,Ka2=8.0×10-14。若要在1L.的盐酸中完全溶解0.01 mol CuS,理论上需要盐酸的最低浓度为___________mol/L(提示:用离子方程式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力,从海带中提取单质碘的流程图如图:

(1)在上述操作中,哪一过程是萃取(_____)。
A.b B.c C.d D.e
(2)写出步骤d的离子方程式:____。
(3)四氯化碳能从碘水中萃取出碘的原因是(1)__(2)__,在进行萃取分液操作时,需要用到的玻璃仪器有____、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在容积为1 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C、D均为气态。根据要求回答下列问题:

(1)容器中反应的化学方程式为__________________________________________。
(2)前2 min,v(A)=______mol·(L·min)-1。
(3)能说明该反应已达到平衡状态的是_____________________
A.混合气体的压强不变
B.混合体系中A、B、C、D四种物质同时存在
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=___(保留小数点后两位)。
(5)下列措施能增大该反应的反应速率的是_______________________________(填选项字母)。
A.容器容积不变,加入与反应无关的氖气
B.升高反应体系的温度
C.容器压强不变,加入与反应无关的氖气
D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)_______v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com