
【题目】海带具有从海水中富集碘的能力,从海带中提取单质碘的流程图如图:

(1)在上述操作中,哪一过程是萃取(_____)。
A.b B.c C.d D.e
(2)写出步骤d的离子方程式:____。
(3)四氯化碳能从碘水中萃取出碘的原因是(1)__(2)__,在进行萃取分液操作时,需要用到的玻璃仪器有____、___。
【答案】D Cl2 + 2I-=2Cl-+I2 四氯化碳不溶于水 碘在四氯化碳中的溶解度比在水中的大 分液漏斗 烧杯
【解析】
由实验流程可知,海带在坩埚中灼烧,b为加入水溶解得到悬浊液,步骤c为过滤,得到含碘离子的溶液,d为通入氯气氧化碘离子得到含碘单质的溶液,然后e为加入四氯化碳萃取分液,得到含碘单质的四氯化碳溶液,通过蒸馏提纯得到碘单质,据此解答。
由实验流程可知,海带在坩埚中灼烧,b为加入水溶解得到悬浊液,步骤c为过滤,得到含碘离子的溶液,d为通入氯气氧化碘离子得到含碘单质的溶液,然后e为加入四氯化碳萃取分液,得到含碘单质的四氯化碳溶液,通过蒸馏提纯得到碘单质,
(1)从海带中提取单质碘的步骤顺序依次为:灼烧、溶解、过滤、通入氯气氧化、萃取分液、蒸馏;所以e属于萃取分液,D项正确;
(2)步骤d为通入氯气氧化碘离子,所以发生的方程式为:Cl2 + 2I-= 2Cl- + I2;
(3)步骤e的操作为加入四氯化碳萃取分液。四氯化碳不溶于水,比水重在溶液下层,且碘在四氯化碳中的溶解度比在水中的大,所以在含I2的溶液中加入CCl4,振荡、静置后,液体分为两层,上层液体接近无色,下层液体呈紫红色;需要用到的玻璃仪器有分液漏斗和烧杯。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】右图的装置中,干燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛装某种溶液。挤压胶头滴管的胶头,下列与实验事实不相符的是

A.CO2(饱和NaHCO3溶液)无色喷泉
B.NO2(H2O含石蕊)红色喷泉
C.NH3(H2O含石蕊)蓝色喷泉
D.HCl(AgNO3溶液)白色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个试管中,均发生反应Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是
试管 | 盐酸浓度(mol/L) | 温度(℃) | 锌的状态 |
A | 0.5 | 20 | 块状 |
B | 0.5 | 20 | 粉末状 |
C | 2 | 35 | 块状 |
D | 2 | 35 | 粉末状 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4 +16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出上述反应电子转移的方向和数目。____
(2)该反应中氧化剂是___,被氧化的元素是___,若有1mol的KMnO4参加反应,则可以氧化___mol的HCl,转移的电子数目为____mol,得到的氯气的体积为___L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设C(s)+CO2(g)===2CO(g) ΔH>0,反应速率为v1;N2(g)+3H2(g)===2NH3(g) ΔH<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
A. 同时增大B. 同时减小C. v1增大,v2减D. v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
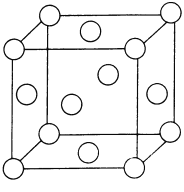
【题目】根据所学物质结构知识,回答下列问题
(1) LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子的外围电子排布式为______________________。第四电离能:Ⅰ4(Co)___________I4(Fe)(填“>”或“<”)。PO43-的空间构型为______________________。
(2)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图所示,则B原子的杂化方式为______________________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,氨硼烷(NH3BH3)的结构式为______________________(标出配位键),写出一种与氨硼烷互为等电子体的分子的化学式:______________________。
(3)常温常压下,硼酸(H3BO3)晶体结构为层状,其二维平面结构如图所示,1mol H3BO3晶体中含有氢键的数目为___________(用NA表示阿伏加德罗常数的值);请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:______________________。

(4)干冰晶体以及Cu晶体的结构都如图表示(○表示一个CO2分子或一个Cu原子),晶体中正八面体和正四面体空隙数的比值为___________。铜的硫化物有三种晶体,其中一种是Cu2+为面心立方最密堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,如果两个最近的离子核间距为acm,NA表示阿伏加德罗常数的值,则该晶体的密度为___________g/cm3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组采用如下方法制作氢氧燃料电池。
(1)如图A所示:a, b均为多孔石墨棒,其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH,则图A 中a极称为_______极 (填电极名称)其电极反应式分别为:_____电解总反应化学方程式为 ___________________。(由于使用多孔石墨棒,此时生成的氢气及氧气中有一部分被石墨棒吸附。)

(2)然后如图B所示,移走直流电源,在a, b极间连接一个小灯炮,可以看到灯泡发光。此时的电流方向是 ___________,(填“a→b”或“b→a”)此时a极称为___________(填电极名称)其电极反应式为______________,b极的电极反应式为____________

(3)若图B中氢氧燃料电池改成甲烷燃料电池则b中电极反应式为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
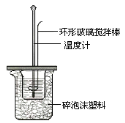
(1)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏 大、偏小、无影响”)
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由__
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是

A. 传感器工作时,工作电极电势高
B. 工作时,H+通过交换膜向工作电极附近移动
C. 当导线中通过1.2×l0-6 mol电子,进入传感器的甲醛为3×10-3 mg
D. 工作时,对电极区电解质溶液的pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com