
【题目】根据所学物质结构知识,回答下列问题
(1) LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子的外围电子排布式为______________________。第四电离能:Ⅰ4(Co)___________I4(Fe)(填“>”或“<”)。PO43-的空间构型为______________________。
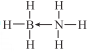
(2)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图所示,则B原子的杂化方式为______________________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,氨硼烷(NH3BH3)的结构式为______________________(标出配位键),写出一种与氨硼烷互为等电子体的分子的化学式:______________________。
(3)常温常压下,硼酸(H3BO3)晶体结构为层状,其二维平面结构如图所示,1mol H3BO3晶体中含有氢键的数目为___________(用NA表示阿伏加德罗常数的值);请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:______________________。

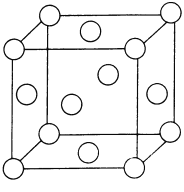
(4)干冰晶体以及Cu晶体的结构都如图表示(○表示一个CO2分子或一个Cu原子),晶体中正八面体和正四面体空隙数的比值为___________。铜的硫化物有三种晶体,其中一种是Cu2+为面心立方最密堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,如果两个最近的离子核间距为acm,NA表示阿伏加德罗常数的值,则该晶体的密度为___________g/cm3(用含a、NA的代数式表示)。
【答案】![]() < 正四面体形
< 正四面体形 ![]()
![]()
![]() 硼酸分子间以氢键缔合,加热时,部分氢键被破坏,硼酸分子与水分子间形成氢键,增大了溶解度 1:8
硼酸分子间以氢键缔合,加热时,部分氢键被破坏,硼酸分子与水分子间形成氢键,增大了溶解度 1:8 ![]()
【解析】
(1)基态Co原子核外有27个电子,根据能量最低原理书写价电子排布式;根据原子轨道处于全空、全满、半满时结构稳定分析;根据价电子互斥理论分析PO43-的空间构型;(2) ①根据B2H6分子结构图,B原子形成了4个杂化轨道;②氨硼烷中N原子提供孤电子对,B原子提供空轨道;原子数相同、价电子数相等的微粒为等电子体;(3)根据硼酸结构图分析1mol H3BO3晶体中含有氢键的数;硼酸分子间以氢键缔合,加热时,部分氢键被破坏,硼酸分子与水分子间形成氢键;(4)干冰晶体以及Cu晶体的结构是面心立方堆积;根据题意,晶胞边长=![]() ;
;
(1)基态Co原子核外有27个电子,价电子排布式为![]() ;Co原子失去3个电子后的外围电子排布是
;Co原子失去3个电子后的外围电子排布是![]() ,Fe原子失去3个电子后的外围电子排布是
,Fe原子失去3个电子后的外围电子排布是![]() ,原子轨道处于半满时结构稳定,所以Ⅰ4(Co)<I4(Fe);PO43-中P原子的杂化轨道数=
,原子轨道处于半满时结构稳定,所以Ⅰ4(Co)<I4(Fe);PO43-中P原子的杂化轨道数=![]() ,配位原子数为4,无孤电子对,所以PO43-为正四面体形;(2) ①根据B2H6分子结构图,B原子形成了4个杂化轨道,所以B原子的杂化方式为
,配位原子数为4,无孤电子对,所以PO43-为正四面体形;(2) ①根据B2H6分子结构图,B原子形成了4个杂化轨道,所以B原子的杂化方式为![]() ;②氨硼烷中N原子提供孤电子对,B原子提供空轨道,结构式为
;②氨硼烷中N原子提供孤电子对,B原子提供空轨道,结构式为 ;原子数相同、价电子数相等的微粒为等电子体,与氨硼烷互为等电子体的分子的化学式为
;原子数相同、价电子数相等的微粒为等电子体,与氨硼烷互为等电子体的分子的化学式为![]() ;(3)根据硼酸结构图,1mol H3BO3晶体中含有3mol氢键,氢键数目是3NA;硼酸分子间以氢键缔合,加热时,部分氢键被破坏,硼酸分子与水分子间形成氢键,所以加热时溶解度增大;(4)干冰晶体以及Cu晶体的结构是面心立方晶胞,6个面心构成一个正八面体的空隙,每个顶点与邻近的3个面心构成一个正四面体的空隙,因此, 正八面体空隙数 : 正四面体空隙数 = 1:8。由晶胞结构可知,该晶胞中有4个Cu2+和4个S2-,所以晶胞的摩尔质量是
;(3)根据硼酸结构图,1mol H3BO3晶体中含有3mol氢键,氢键数目是3NA;硼酸分子间以氢键缔合,加热时,部分氢键被破坏,硼酸分子与水分子间形成氢键,所以加热时溶解度增大;(4)干冰晶体以及Cu晶体的结构是面心立方晶胞,6个面心构成一个正八面体的空隙,每个顶点与邻近的3个面心构成一个正四面体的空隙,因此, 正八面体空隙数 : 正四面体空隙数 = 1:8。由晶胞结构可知,该晶胞中有4个Cu2+和4个S2-,所以晶胞的摩尔质量是![]() g/mol。晶胞中最近两个离子是顶点和邻近的正四面体的空隙中心的硫离子,离子核间距为晶胞的体对角线的四分之一,故体对角线长为4acm,晶胞边长=
g/mol。晶胞中最近两个离子是顶点和邻近的正四面体的空隙中心的硫离子,离子核间距为晶胞的体对角线的四分之一,故体对角线长为4acm,晶胞边长=![]() ,晶胞体积为
,晶胞体积为![]() ;所以
;所以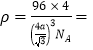
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A. 醋酸溶于水:CH3COOH===CH3COO-+H+
B. NaHSO4溶于水:NaHSO4===Na++HSO4-
C. 碳酸氢钠溶于水:NaHCO3![]() HCO
HCO![]() +Na+
+Na+
D. 次氯酸溶于水:HClO![]() H++ClO-
H++ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列四个图像:

下列反应中全部符合上述图像的反应是 ( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH1<0
2NH3(g) ΔH1<0
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH2>0
2SO2(g)+O2(g) ΔH2>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH3<0
4NO(g)+6H2O(g) ΔH3<0
D. H2(g)+ CO(g)![]() C(s)+H2O(g) ΔH4>0
C(s)+H2O(g) ΔH4>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含铁的氯化物、CuCl2、SiO2、MnO2等杂质。工业上以卤块为原料可制得轻质氧化镁,工艺流程如图所示:

已知:生成氢氧化物沉淀的pH如下表所示:
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 6.0 | 8.0 |
Mn(OH)2 | 7.3 | 9.3 |
Mg(OH)2 | 9.1 | 11.1 |
请回答下列问题
(1)滤渣1的成分有______________________(填化学式)。加入试剂1的目的是___________。
(2)步骤“加NaOH”需要调节pH值的范围为______________________。
(3)沉淀1的成分为______________________ (填化学式),步骤“加水煮沸”发生反应的化学方程式为______________________。
(4)步骤“加水煮沸”不能时间太长,原因是______________________。
(5)最近研究表明,常温下在含有Mg2+浓度为1.5mol/L的溶液中加入2倍于Mg2+的物质的量的NH4HCO3,控制pH值在9.5左右,镁的沉淀率能达到99%。产物为一种含结晶水的复盐,可用于煅烧制取轻质氧化镁,经XDR(X射线衍射)分析该复盐含水与含镁的物质的量相等。写出制取该复盐的离子方程式:_________________________________。
(6)除了OH-之外,S2-也是一种常见的金属离子沉淀剂。本质原因是一些金属硫化物的溶解度极小。已知:25℃时,CuS的溶度积为4×10-36,H2S的Ka1=1.25×10-7,Ka2=8.0×10-14。若要在1L.的盐酸中完全溶解0.01 mol CuS,理论上需要盐酸的最低浓度为___________mol/L(提示:用离子方程式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力,从海带中提取单质碘的流程图如图:

(1)在上述操作中,哪一过程是萃取(_____)。
A.b B.c C.d D.e
(2)写出步骤d的离子方程式:____。
(3)四氯化碳能从碘水中萃取出碘的原因是(1)__(2)__,在进行萃取分液操作时,需要用到的玻璃仪器有____、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在容积为1 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C、D均为气态。根据要求回答下列问题:

(1)容器中反应的化学方程式为__________________________________________。
(2)前2 min,v(A)=______mol·(L·min)-1。
(3)能说明该反应已达到平衡状态的是_____________________
A.混合气体的压强不变
B.混合体系中A、B、C、D四种物质同时存在
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=___(保留小数点后两位)。
(5)下列措施能增大该反应的反应速率的是_______________________________(填选项字母)。
A.容器容积不变,加入与反应无关的氖气
B.升高反应体系的温度
C.容器压强不变,加入与反应无关的氖气
D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)_______v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c的最高价氧化物对应水化物可以反应
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究NO2与过氧化钠反应的情况,甲、乙两位同学设计了如下实验,其装置如图。

已知:2NO2+2NaOH==NaNO3+NaNO2+H2O
试回答下列问题:
(1)仪器A的名称是________________,仪器B的作用是________________________。
(2)装入药品前必须检查装置的气密性,具体操作方法是________________________。
(3)试管中生成NO2反应的离子方程式是________________________________________。
(4)实验过程中,两位同学通过检验得知气体产物中含有较多氧气。该同学通过查阅资料了解NO2具有氧化性,据此甲同学判断NO2与过氧化钠反应可得到氧气,而乙同学认为该结论不合理,理由是__________。为验证自己的想法,乙同学对上述装置进行了改进,具体做法是________________。
(5)改进装置后,再进行实验,两位同学发现过氧化钠的颜色由淡黄色逐渐变成白色,且检验不出氧气的生成,该反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com