
【题目】有关物质的转化关系如下图所示。A是生石灰的主要成分,B是一种具有漂白性的无色气体,D是一种常见的无色液体,F是某种补血剂的有效成分,G是一种常见的强酸,H的摩尔质量为72 g·mol-1。

(1)A的化学式为____________。
(2)D的电子式为____________。
(3)写出反应①的化学方程式:________________________。
(4)写出反应②的离子方程式:________________________。
【答案】 CaO ![]() 4CaSO3
4CaSO3![]() 3CaSO4+CaS 2Fe3++SO2+2H2O===2Fe2++SO
3CaSO4+CaS 2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
【解析】A是生石灰的主要成分,A是氧化钙。B是一种具有漂白性的无色气体,B是二氧化硫,E是亚硫酸钙。D是一种常见的无色液体,D是水,F是某种补血剂的有效成分,F是亚铁盐,G是一种常见的强酸,H的摩尔质量为72 g·mol-1,因此H是CaS,K是CaSO4,则G是硫酸,C是铁盐。(1)根据以上分析可知A的化学式为CaO;(2)D是水,电子式为![]() ;(3)根据以上分析可知反应①的化学方程式为4CaSO3
;(3)根据以上分析可知反应①的化学方程式为4CaSO3![]() 3CaSO4+CaS。(4)反应②的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
3CaSO4+CaS。(4)反应②的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,250C时,它们的物质的量分数随PH的变化如图所示,下列叙述错误的是
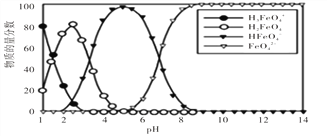
A. 向pH=5的高铁酸盐溶液中加入NaOH溶液,离子方程式为:HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2 ,K2=4.8×10-4,K3=5.0×10-8,当pH=4时,溶液中c(HFeO4-)/c(H2FeO4)=1.2
D. pH=2时,溶液中含铁粒子浓度的大小关系为:c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
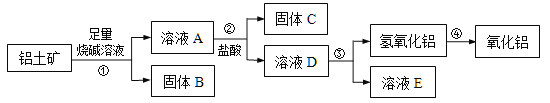
(1)固体B的主要用途有(写出1条即可)________________。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是________________________________;_______________________________________;
第③步中,用足量氨水制氢氧化铝的化学方程式是________________________________。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是__________。(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】P、S、Cl最高正价依次增大,原因是( )
A. P、S、Cl都是非金属 B. 电子层数不同
C. P、S、Cl原子半径依次减小 D. P、S、Cl最外层电子数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是________(填字母,下同)。
a. CH4 b. CO c. SO2
②下列处理废水的方法属于中和法的是________。
a. 用熟石灰处理废水中的酸
b. 用臭氧处理废水中的氰化物
c. 用铁粉回收废水中的铜
③下列做法会造成土壤重金属污染的是________。
a. 作物秸杆露天焚烧
b. 废干电池就地填埋
c. 废旧塑料随意丢弃
(2)新鲜牛肉含蛋白质、脂肪、糖类、维生素A、维生素C、钙、铁等,其中:
①属于人体所需微量元素的是________。
②属于脂溶性维生素的是________。
③可为人体提供能量的是________、________和________。
(3)材料的发展与应用促进了人类社会的进步。
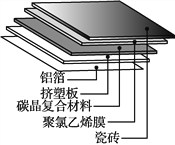
①碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是________;属于硅酸盐材料的是________;属于高分子材料的是挤塑板和________。
②吸附材料具有多孔、表面积大的特点。活性炭吸附NO2的过程中,会伴有C与NO2的反应,产物为两种常见无毒气体。写出该反应的化学方程式:_________________________________________。
③LiMn2O4是锂离子电池的一种正极材料,可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质。写出该反应的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷![]() 是第四周期
是第四周期![]() 族元素,可以形成
族元素,可以形成![]() 、
、![]() 、
、![]() 、
、![]() 等化合物,有着广泛的用途.回答下列问题:
等化合物,有着广泛的用途.回答下列问题:
(1)画出砷的原子结构示意图________.
(2)工业上常将含砷废渣(主要成分为![]() )制成浆状,通入
)制成浆状,通入![]() 氧化,生成
氧化,生成![]() 和单质硫.写出发生反应的化学方程式___________________.该反应需要在加压下进行,原因是_____________.
和单质硫.写出发生反应的化学方程式___________________.该反应需要在加压下进行,原因是_____________.
(3)已知: ![]()
![]()
![]()
则反应![]() 的
的![]() ________.
________.
(4)![]() 时,将
时,将![]() 、
、![]() 和
和![]() 溶液混合,发生反应:
溶液混合,发生反应: ![]() .溶液中
.溶液中![]() 与反应时间
与反应时间![]() 的关系如图所示.①下列可判断反应达到平衡的是________(填标号).
的关系如图所示.①下列可判断反应达到平衡的是________(填标号).

a. 溶液的![]() 不再变化
不再变化
b. ![]()
c. ![]() 不再变化
不再变化
d. ![]()
②![]() 时,
时, ![]() ________
________![]() (填“大于”“小于”或“等于”).
(填“大于”“小于”或“等于”).
③![]() 时
时![]() ________
________![]() 时
时![]() (填“大于”“小于”或“等于”),理由是________.
(填“大于”“小于”或“等于”),理由是________.
④若平衡时溶液的![]() ,则该反应的平衡常数
,则该反应的平衡常数![]() 为________.
为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医院在对某类病人的尿液进行检查时常把氢氧化钠溶液和硫酸铜溶液加入到其尿液中并加热,如果观察到产生红色沉淀,说明该尿液中含有
A.食醋B.白酒C.食盐D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)十O2(g)=2SO3(g) △H =-198kJ·mol-1,在V2O3存在时,该反应机理为:V2O3+ SO2-→+2VO3+ SO3(快) 4VO2+O2→2 V2O3(慢)。下列说法正确的是
A. 反应速率主要取决于V2O3的质量 B. VO2是该反应的催化剂
C. 该反应逆反应的活化能大于198kJ/mol D. 升高温度,该反应的△H增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com