
����Ŀ����![]() �ǵ�������
�ǵ�������![]() ��Ԫ�أ������γ�
��Ԫ�أ������γ�![]() ��
��![]() ��
��![]() ��
��![]() �Ȼ�������Ź㷺����;���ش��������⣺
�Ȼ�������Ź㷺����;���ش��������⣺
��1���������ԭ�ӽṹʾ��ͼ________��
��2����ҵ�ϳ��������������Ҫ�ɷ�Ϊ![]() ���Ƴɽ�״��ͨ��
���Ƴɽ�״��ͨ��![]() ����������
����������![]() �͵�����д��������Ӧ�Ļ�ѧ����ʽ___________________���÷�Ӧ��Ҫ�ڼ�ѹ�½��У�ԭ����_____________��
�͵�����д��������Ӧ�Ļ�ѧ����ʽ___________________���÷�Ӧ��Ҫ�ڼ�ѹ�½��У�ԭ����_____________��
��3����֪�� ![]()
![]()
![]()
��Ӧ![]() ��
��![]() ________��
________��
��4��![]() ʱ����
ʱ����![]() ��
��![]() ��
��![]() ��Һ��ϣ�������Ӧ��
��Һ��ϣ�������Ӧ�� ![]() ����Һ��
����Һ��![]() �뷴Ӧʱ��
�뷴Ӧʱ��![]() �Ĺ�ϵ��ͼ��ʾ�������п��жϷ�Ӧ�ﵽƽ�����________�����ţ���
�Ĺ�ϵ��ͼ��ʾ�������п��жϷ�Ӧ�ﵽƽ�����________�����ţ���

a. ��Һ��![]() ���ٱ仯
���ٱ仯
b. ![]()
c. ![]() ���ٱ仯
���ٱ仯
d. ![]()
��![]() ʱ��
ʱ�� ![]() ________
________![]() ������ڡ���С�ڡ����ڡ�����
������ڡ���С�ڡ����ڡ�����
��![]() ʱ
ʱ![]() ________
________![]() ʱ
ʱ![]() ������ڡ���С�ڡ����ڡ�����������________��
������ڡ���С�ڡ����ڡ�����������________��
����ƽ��ʱ��Һ��![]() ����÷�Ӧ��ƽ�ⳣ��
����÷�Ӧ��ƽ�ⳣ��![]() Ϊ________��
Ϊ________��
���𰸡� ![]()
![]() , ��ѹ��Ӧ����������ƽ�����ƣ����������Ч��
, ��ѹ��Ӧ����������ƽ�����ƣ����������Ч�� ![]() ac ���� С��
ac ���� С�� ![]() ʱ
ʱ![]() Ũ�ȸ�С����Ӧ���ʸ���
Ũ�ȸ�С����Ӧ���ʸ��� ![]()
����������1������33��Ԫ�أ���ԭ�ӽṹʾ��ͼΪ![]() ��
��
��2����ҵ�ϳ��������������Ҫ�ɷ�Ϊ![]() ���Ƴɽ�״��ͨ��
���Ƴɽ�״��ͨ��![]() ����������
����������![]() �͵����÷�Ӧ�Ļ�ѧ����ʽΪ
�͵����÷�Ӧ�Ļ�ѧ����ʽΪ![]() ���÷�Ӧ�ķ�Ӧ������������룬��������û���������ʼ�ѹ����������Ӧ���ʣ����ҿ���ʹ��ѧƽ��������Ӧ�����ƶ������������Ч�ʡ���ˣ��÷�Ӧ��Ҫ�ڼ�ѹ�½�����
���÷�Ӧ�ķ�Ӧ������������룬��������û���������ʼ�ѹ����������Ӧ���ʣ����ҿ���ʹ��ѧƽ��������Ӧ�����ƶ������������Ч�ʡ���ˣ��÷�Ӧ��Ҫ�ڼ�ѹ�½�����
��3����֪����![]() ��
�� ![]() ��
�� ![]() �����ݸ�˹��������
�����ݸ�˹��������![]() ��
��![]() �ۿɵ÷�Ӧ
�ۿɵ÷�Ӧ![]() ��������
��������![]() ��
��
��4��![]() ʱ����
ʱ����![]() ��
��![]() ��
��![]() ��Һ��ϣ�����������Ӧ����
��Һ��ϣ�����������Ӧ����![]() ��
�� ![]() .��Ϻ�����Ӧ��
.��Ϻ�����Ӧ�� ![]() ��
��
��a. ��Һ��![]() ���ٱ仯��˵������ֵ�Ũ�ȱ��ֲ��䣬a��ȷ�� b.
���ٱ仯��˵������ֵ�Ũ�ȱ��ֲ��䣬a��ȷ�� b. ![]() ����˵������Ӧ���ʺ��淴Ӧ������ȣ�c.
����˵������Ӧ���ʺ��淴Ӧ������ȣ�c. ![]() ���ٱ仯��˵�������Ũ�ȱ��ֲ��䣬c��ȷ�� d.
���ٱ仯��˵�������Ũ�ȱ��ֲ��䣬c��ȷ�� d. ![]() ����˵��
����˵��![]() ���ֲ��䡣�������������жϷ�Ӧ�ﵽƽ�����ac��
���ֲ��䡣�������������жϷ�Ӧ�ﵽƽ�����ac��
��![]() ʱ����Ӧ����������Ӧ������У�����
ʱ����Ӧ����������Ӧ������У�����![]() ����
����![]() ��
��
��![]() ʱ
ʱ![]() С��
С��![]() ʱ
ʱ![]() ����Ϊ
����Ϊ![]() ʱ
ʱ![]() Ũ�ȸ�С����Ӧ���ʸ�����
Ũ�ȸ�С����Ӧ���ʸ�����
����ƽ��ʱ��Һ��![]() ��c(H+)=
��c(H+)= ![]() ��c(OH-)=
��c(OH-)= ![]() ����ͼ��֪����ʱ
����ͼ��֪����ʱ![]()
![]() ���������غ��֪��
���������غ��֪�� ![]() ,��÷�Ӧ��ƽ�ⳣ��
,��÷�Ӧ��ƽ�ⳣ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ��ķ�Ӧ��N2(g)��3H2(g) ![]() 2NH3��g����һ�����淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪�γ�1mol H��H����1mol N��H����1mol N
2NH3��g����һ�����淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪�γ�1mol H��H����1mol N��H����1mol N![]() N���ų��������ֱ�Ϊ436KJ��391KJ��946KJ����
N���ų��������ֱ�Ϊ436KJ��391KJ��946KJ����
(1)��1mol N2��ȫ��Ӧ����NH3��______������ա��ų�������_____KJ��
(2)�����1mol N2 �� 3mol H2��ϣ���һ��������ʹ���ַ�Ӧ����Ӧ�ų���������С��������ֵ����ԭ����_____________________________________________________��
(3)ʵ����ģ�ҵ�ϳɰ�ʱ�����ݻ�Ϊ2L���ܱ������н��У���Ӧ����10min������10mol NH3������N2��ʾ�Ļ�ѧ��Ӧ������________mol��L ��1��min��1��
(4)һ�������£����ɺϳɰ���Ӧ�ﵽ��ѧƽ��ʱ������˵����ȷ������____��
a.����Ӧ���ʺ��淴Ӧ�������
b.����Ӧ��������淴Ӧ����Ϊ0
c.N2��ת���ʴﵽ���ֵ
d. N2��H2��Ũ�����
e.N2��H2��NH3������������
f.��Ӧ�ﵽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
���������ǻ���ɫ��״�ᾧ����ṹ��ͼ��ʾ����������ˮ�����ڵ����ᡢ����̼�������л��ü����ڷ��ڵ�NaOHϡ��Һ�л�Ѹ��ˮ�⡣�ش��������⣺

��1��Se��S����һ����ͬ����Ԫ�أ����������Ų�ʽΪ_______��
��2����һ�����ܣ�S____���������������ͬ��P���縺�ԣ�S____P
��3��������������Pԭ�Ӳ�ȡ______�ӻ�����PO3-��Ϊ�ȵ�����Ļ�������ӵĻ�ѧʽΪ______��
��4������̼��______������ԡ��Ǽ��ԡ������ӡ�
��5����NA��ʾ����٤����������ֵ��0.1mol�����������к��еŵ��Ӷ���Ϊ____��
��6���������ᣨHN3���ڳ�������һ��Һ�壬�е�ϸߣ�Ϊ308.8K����Ҫԭ����________��
��7���������ƾ���NaCl�ͽṹ���侧����Na+��OH-֮��ľ���Ϊacm ��������Na+����λ��Ϊ_______����NA��ʾ����٤����������ֵ��NaOH���ܶ�Ϊ_____g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ͭ��Ũ��������ڼ��������·������·�Ӧ����Ӧ����ʽ����ƽ����Cu+2H2SO4(Ũ)![]() CuSO4+A��+2H2O����ͨ����������������������⣺
CuSO4+A��+2H2O����ͨ����������������������⣺
��1��A���ʿ��Ե���������γɡ���AӦ������________������ĸ������д��
a. �� b. �� c. �� d. ���������� e. ����������
A���ʿ���ʹ����KMnO4��Һ��ɫ���˷�Ӧ��________����д��ѧʽ����ͬ��ʧȥ���ӣ���������__________��
��2��һ������ͭƬ��100mL 18 mol/L��ŨH2SO4��ַ�Ӧ������÷�Ӧ������ת����0.2mol���ӣ����ɵ�CuSO4������Ϊ_____g�����ɵ�A�����ڱ�״�������Ϊ_____L����������ȫ���ݳ�����ʣ���H2SO4��Ũ��Ϊ____________mol/L��������Һ����ı仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ��A����ʯ�ҵ���Ҫ�ɷ���B��һ�־���Ư���Ե���ɫ������D��һ�ֳ�������ɫҺ����F��ij�ֲ�Ѫ������Ч�ɷ���G��һ�ֳ�����ǿ����H��Ħ������Ϊ72 g��mol��1��

��1��A�Ļ�ѧʽΪ____________��
��2��D�ĵ���ʽΪ____________��
��3��д����Ӧ�ٵĻ�ѧ����ʽ��________________________��
��4��д����Ӧ�ڵ����ӷ���ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V L Al2(SO4)3��Һ�м��������ˮ�����˵ó�����Ȼ���ڸ��������ճ������ð�ɫ����m g������ԭ��Һ˵����ȷ���� ( )
A. Al3+�����ʵ���Ũ��Ϊ![]() B. ���ʵ����ʵ���Ũ��
B. ���ʵ����ʵ���Ũ��![]()
C. Al3+�����ʵ���![]() D. SO42-�����ʵ���Ũ��
D. SO42-�����ʵ���Ũ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ĸ��ֻ�ѧԪ���У������Ԫ�ء���������Ԫ�ء�ռϸ����������Ԫ��������
A. C��O��C B. C��H��O C. C��O��N D. C��O��O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����̼����ﴦ����CuSO4��ˮ��ý���ͭ�����ݳ���м�ͻ���̿����������ʱ����÷�ˮ��Cu2+Ũ���ڲ�ͬ��̼������(x)��������ʱ�ʱ仯��������ͼ��ʾ���������۲���������

A. ��ͼ��֪������̿��Cu2+����һ������������
B. ��м�ͻ���̿������Һ���γ���أ���мΪ����
C. ������̼�������պ�CuSO4��ˮ��ͭ�ķ�Ӧԭ����Fe+CuSO4=FeSO4+Cu
D. ������̼���������̼������(x)��һ������߷�ˮ��Cu2+��ȥ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:2FeSO4��7H2O![]() Fe2O3+SO2��+SO3��+14H2O��������ͼ��ʾװ�ü���FeSO4��7H2O�����зֽ�������˵������ȷ����
Fe2O3+SO2��+SO3��+14H2O��������ͼ��ʾװ�ü���FeSO4��7H2O�����зֽ�������˵������ȷ����
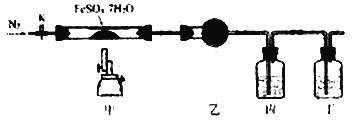
A. �ҡ��������п�����ʢװ��ˮCuSO4��Ba(NO3)2��Һ��Ʒ����Һ
B. ʵ��ʱӦ�ȴ�K������ͨ��N2���ٵ�ȼ�ƾ����
C. ���в��������ϡ�����ܽ⣬�ٵμ�KSCN����Һ���
D. ��Ӧ�ڶ�װ�ú�������ʢ��NaOH��Һ��ϴ��ƿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com