
【题目】铬及其化合物在生产生活中具有十分广泛的用途。工业上以铬铁矿(主要成分是Fe(CrO2)2,Cr元素为+3价。含少量MgCO3、Al2O3、SiO2等杂质)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:
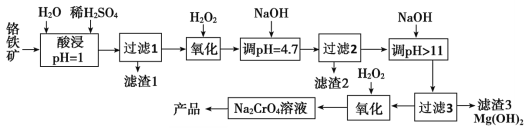
已知:+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
(1)如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__。
(2)若省略“过滤2”步骤,产品中可能混有__(写化学式)。
(3)流程中两次使用了H2O2进行氧化,第二次氧化时反应的离子方程式为__。
(4)制取铬酸钠后的酸性废水中含有Cr2O![]() ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O![]() 溶液形成原电池,使Cr2O
溶液形成原电池,使Cr2O![]() 转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
(5)产品铬酸钠可用如图所示方法冶炼铬。
![]()
②的化学方程式为__,在实验室中引发该反应用到的两种药品是__(填化学式)。
【答案】FeOCr2O3 Na[Al(OH)4] 2CrO![]() +3H2O2+2OH-=2CrO
+3H2O2+2OH-=2CrO![]() +4H2O Cr2O
+4H2O Cr2O![]() +6e-+14H+=2Cr3+7H2O 2Cr3++Ca(OH)2=Cr(OH)3+3Ca2+
+6e-+14H+=2Cr3+7H2O 2Cr3++Ca(OH)2=Cr(OH)3+3Ca2+ ![]() Cr2O3+2Al
Cr2O3+2Al![]() 2Cr+Al2O3 KClO3、Mg
2Cr+Al2O3 KClO3、Mg
【解析】
根据化合物中化合价代数和为0,求出Fe元素的化合价,写出氧化物形式;根据氢氧化铝的两性写出杂质的化学式;根据题中图示,判断第二次双氧水氧化CrO2-成为CrO42-,写出离子方程式;根据原电池的正极发生还原反应,写出电极反应,由Cr3+与碱反应生成Cr(OH)3沉淀,写出离子方程式,由离子方程式写出K表达式,根据题中给出的Ksp值求算K值;根据铝热反应写出化学方程式,以此解答。
(1)铬铁矿主要成分是Fe(CrO2)2,Cr元素为+3价,O元素为-2价,设Fe元素化合价为x,由化合物中化合价代数和为0可知,x+3×2=2×2×2,x=+2,Fe元素为+2价,则Fe(CrO2)2可写成FeO·Cr2O3;答案为FeO·Cr2O3。
(2)Al(OH)3溶于强碱,如果把“过滤2”步骤省略,则pH>11时,Al(OH)3会溶解,引入杂质离子Al(OH)4-,生成Na[Al(OH)4],使产品不纯;答案为Na[Al(OH)4]。
(3)H2O2第二次氧化CrO2-,使它变为CrO42-,则Cr元素失电子,化合价升高,H2O2中的氧元素得电子,化合价降低,则反应离子方程式为:2CrO2-+3H2O2+2OH=2CrO42-+4H2O;答案为2CrO2-+3H2O2+2OH=2CrO42-+4H2O。
(4)在原电池的正极上发生得电子的还原反应,即Cr2O![]() 得电子转化为Cr3+,电极反应为Cr2O72-+6e-+14H+=2Cr3++7H2O,用石灰乳对Cr3+进行沉降,沉降Cr3+的离子方程式为:2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓, 由2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓可知,K=
得电子转化为Cr3+,电极反应为Cr2O72-+6e-+14H+=2Cr3++7H2O,用石灰乳对Cr3+进行沉降,沉降Cr3+的离子方程式为:2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓, 由2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓可知,K=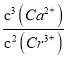 ,根据Ca(OH)2
,根据Ca(OH)2![]() Ca2++2OH-,Ksp[Ca(OH2)]=c(Ca2+)×c2(OH-),c(Ca2+)=
Ca2++2OH-,Ksp[Ca(OH2)]=c(Ca2+)×c2(OH-),c(Ca2+)=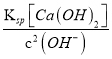 =
=![]() ,Cr(OH)3
,Cr(OH)3![]() Cr3++3OH-Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-),c(Cr3+)=
Cr3++3OH-Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-),c(Cr3+)=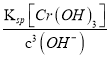 =
=![]() ,则K=
,则K=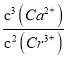 =
=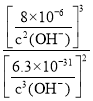 =
= ![]() ;答案为Cr2O72-+6e-+14H+=2Cr3++7H2O,2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓,
;答案为Cr2O72-+6e-+14H+=2Cr3++7H2O,2Cr3++3Ca(OH)2=3Ca2++2Cr(OH)3↓,![]() 。
。
(5)由于Cr2O3熔点很高,Al的金属性比Cr强,利用铝热反应制取Cr,即Cr2O3+2Al![]() Al2O3+2Cr,实验室引发铝热反应常用Mg和KClO3,其中镁条为引燃剂,氯酸钾为助燃剂;答案为Cr2O3+2Al
Al2O3+2Cr,实验室引发铝热反应常用Mg和KClO3,其中镁条为引燃剂,氯酸钾为助燃剂;答案为Cr2O3+2Al![]() Al2O3+2Cr,Mg、KClO3。
Al2O3+2Cr,Mg、KClO3。


科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1mol P4S3分子中含有9mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )

A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中的![]() 可用连二亚硫酸根(
可用连二亚硫酸根(![]() )为媒介处理使其转化为
)为媒介处理使其转化为![]() ,其原理如图所示。下列说法正确的是( )
,其原理如图所示。下列说法正确的是( )

A.燃煤烟气中![]() 的处理仅利用的是电解原理
的处理仅利用的是电解原理
B.阴极区的电极反应式为![]()
C.若通电过程中吸收![]() (标准状况下),则阳极可以产生
(标准状况下),则阳极可以产生![]() 气体
气体
D.反应一段时间后,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题,观察图片,回答问题。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。
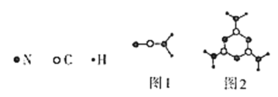
(1)图1中化学键σ键与π键之比为________;图2中碳原子的杂化方式为________。
(2)在基态![]() 原子中,核外存在_____对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为____形。
原子中,核外存在_____对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为____形。
(3)碳的最高价含氧酸根的空间构型是__________;硝酸的酸性强于亚硝酸的原因是__________。
Ⅱ.传统锂电池的主要成分是![]() ,其晶胞结构如图所示;因结构中存在笼状空隙,可以与
,其晶胞结构如图所示;因结构中存在笼状空隙,可以与![]() 和
和![]() 发生位置替换,形成储电性能更加优良的化合物
发生位置替换,形成储电性能更加优良的化合物![]() 。
。
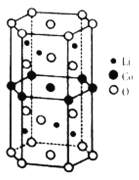
(4)基态![]() 原子的价电子排布式为_____________;化合物
原子的价电子排布式为_____________;化合物![]() 中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是__________。
中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是__________。
(5)已知化合物中各原子半径依次为:![]() ,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为__________(用含有a、b、c、d、e、m、n的式子表示)。
,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为__________(用含有a、b、c、d、e、m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,M是W的最高价氧化物对应的水化物,常温下,0.01 molL﹣1 M溶液的pH=12,X、Y、Z的单质e、f、g在通常状态下均为气态,并有如图所示的转化关系(反应条件略去)。在双原子单质分子中,f分子含共用电子对数最多,1个乙分子含10个电子。下列说法正确的是( )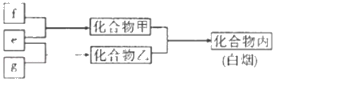
A.简单离子半径:Z>Y>W
B.X能分别与W、Y、Z组成共价化合物
C.化合物丙能抑制水电离
D.X与Y元素形成的最简单的气态氢化物是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
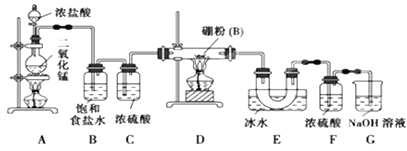
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com