
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B. 晶体中与每个K+距离最近的K+有8个
C. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D. 晶体中,0价氧与﹣2价氧的数目比为2:1
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡如图所示.

(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为___________
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
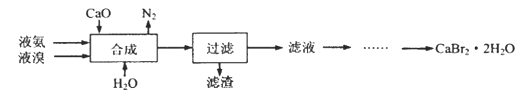
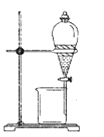
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ①④⑤⑥⑦⑧C. ③④⑤⑥⑦D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它在爆炸时发生的化学反应为2KNO3+3C+S=A+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为__________。
②在生成物中,A的晶体类型为_______,含极性共价键的分子的中心原子轨道杂化类型为_____。
③已知CN-与N2互为等电子体,推算HCN分子中σ键与π键数目之比为_____。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
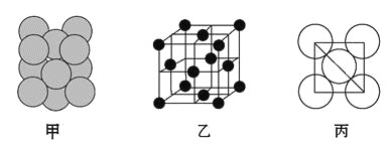
(3)若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。则晶胞中该原子的配位数为________,该单质晶体中原子的堆积方式为四种基本堆积方式中的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
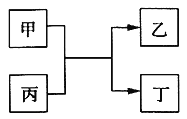
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答
(1)钴位于元素周期表的第__族,其基态原子中未成对电子个数为__。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__,所含非金属元素的电负性由大到小的顺序是__。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__。

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:![]() 、
、![]() 、
、![]()
B.在含等物质的量的![]() 、
、![]() 、
、![]() 的溶液中加入Zn:
的溶液中加入Zn:![]() 、
、![]() 、
、![]() 、
、![]()
C.在含等物质的量的![]() 、KOH的溶液中通入
、KOH的溶液中通入![]() :
:![]() 、KOH、BaCO3、
、KOH、BaCO3、![]()
D.在含等物质的量的AlO2-、![]() 、
、![]() 溶液中,逐滴加入盐酸:
溶液中,逐滴加入盐酸:![]() 、
、![]() 、AlO2-、
、AlO2-、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com