


科目:高中化学 来源: 题型:
| A、10g H2和10g O2 |
| B、5.6LN2(标准状况)和11g CO2 |
| C、18g H2O和0.5mol Br2 |
| D、224mL H2(标准状况)和0.1mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述不正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述不正确的是( )A、断开K2,闭合K1时,总反应的离子方程式为:2H2O+2Cl-
| ||||
| B、断开K2,闭合K1时,铜电极产生的气体略多于石墨 | ||||
| C、断开K1,闭合K2时,铜电极上的电极反应为:H2-2e-=2 H+ | ||||
| D、断开K1,闭合K2时,溶液中的Na+向石墨电极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
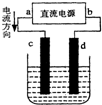 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、d为阳极 |
| B、将淀粉KI试纸的玻璃棒靠近d处一段时间会变蓝色 |
| C、电解过程中转移0.2mol电子,d电极质量增加6.4克 |
| D、电解过程中,铜离子向C极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com