

| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
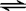 CO2(g)十H2 (g)
CO2(g)十H2 (g)| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| 0.12mol/L×0.12mol/L |
| 0.08mol/L×0.18mol/L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题:
实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:
 利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:| nA |
| tA |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com