
 实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题:
实验测得在67℃时,某反应体系在CCl4溶液中各物质的浓度随时间的变化如图,请回答下列问题:| △c |
| △t |
| △c(O2) |
| △t |
| 0.42mol/L |
| 5min |
| c4(NO2)?c(O2) |
| c2(N2O5) |
| c4(NO2)?c(O2) |
| c2(N2O5) |


科目:高中化学 来源: 题型:
| A、由于碘在酒精中的溶解度大,可以用酒精把碘水中的碘萃取出来 |
| B、水的沸点为100℃,酒精的沸点为78.5℃,所以用加热蒸馏的方法使含水的酒精变为无水酒精 |
| C、由于沙子和水不相溶,因此可用过滤法分离沙子与水的混合物 |
| D、NaCl的溶解度随温度下降而减小,可以用冷却法从热的含少量的KNO3的NaCl浓溶液中分离得到纯净的NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
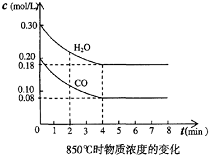 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| HClO | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
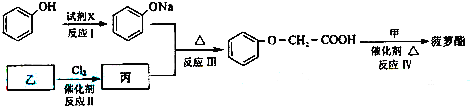
 -O-CH2-COOH发生酯化反应的产物.
-O-CH2-COOH发生酯化反应的产物.| Cl2 |
| 催化剂 |
 R-ONa
R-ONa| Cl-R′ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H-H比N≡N更牢固 |
| B、N≡N键能约为946 kJ/mol |
| C、合成氨反应选择适当的催化剂是为了提高H2的转化率 |
| D、0.5mol N2和1.5mol H2在题给条件下充分反应,放出热量为46.2 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com